Система оценивания экзаменационной работы по химии
За правильный ответ на каждое из заданий 1-8, 12-16, 20, 21, 27-29 ставиться 1 балл.
Задания 9–11, 17–19, 22–26 считаются выполненными верно, если правильно указана последовательность цифр. За полный правильный ответ в заданиях 9–11, 17–19, 22–26 ставится 2 балла; если допущена одна ошибка – 1 балл; за неверный ответ (более одной ошибки) или его отсутствие – 0 баллов.
Теория по заданию:
- Тема №7 «Свойства простых веществ — металлов»
- Тема №8 «Свойства простых веществ — неметаллов»
- Тема №9 «Свойства соединений неметаллов»
- Тема №10 «Характерные химические свойства основных, амфотерных и кислотных оксидов»
- Тема №11 «Свойства оснований, амфотерных гидроксидов и кислот»
- Тема №12 «Соли»
- Сводная таблица химических свойств металлов
- Карта реакций для неметаллов
Тест по заданию:
Установите соответствие между простым веществом и реагентами, с каждым из которых оно может взаимодействовать: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| НАЗВАНИЕ ВЕЩЕСТВА | РЕАГЕНТЫ |
| A) Алюминий | 1) Fe2O3, HNO3 (р-р), NaOH |
| Б) Кислород | 2) Fe, HNO3, H2 |
| B) Сера | 3) HI, Fe, SO2 |
| Г) Калий | 4) C2H5OH, H2O, Cl2 |
| 5) CaCl2, KOH, HCl |
Установите соответствие между названием оксида и формулами веществ, с которыми он может взаимодействовать: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| НАЗВАНИЕ ОКСИДА | ФОРМУЛЫ ВЕЩЕСТВ |
| A) оксид калия | 1) H2O, MgO, LiOH |
| Б) оксид углерода(II) | 2) Fe3O4, H2O, Si |
| B) оксид хрома(III) | 3) CuO, Fe3O4, O2 |
| Г) оксид фосфора(V) | 4) H2O, N2O5, H3PO4 |
| 5) H2SO4, NaOH, Al |
Установите соответствие между названием оксида и перечнем веществ, с каждым из которых этот оксид может взаимодействовать: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| НАЗВАНИЕ ОКСИДА | ВЕЩЕСТВА |
| A) оксид углерода(IV) | 1) C, HNO3 (р-р), Cu |
| Б) оксид меди(II) | 2) Al, Fe2O3, H2O |
| B) оксид кальция | 3) Mg, Ca(OH)2 (p-p), H2O |
| Г) оксид углерода(II) | 4) NaOH (тв), Cl2, O2 |
| 5) H2O, SiO2, H2SO4 (р-р) |
Установите соответствие между формулой вещества и реагентами, с каждым из которых это вещество может взаимодействовать: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| НАЗВАНИЕ ВЕЩЕСТВА | РЕАГЕНТЫ |
| A) NaOH | 1) Ca, MgO, Pb(NO3)2 |
| Б) CO | 2) Fe3O4,H2O, Si |
| B) Al2O3 | 3) H2, Fe3O4, O2 |
| Г) HCl | 4) Cl2, N2O5, H3PO4 |
| 5) HCl, NaOH, Na2CO3 |
Установите соответствие между формулой вещества и реагентами, с каждым из которых это вещество может взаимодействовать: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ФОРМУЛА ВЕЩЕСТВА | РЕАГЕНТЫ |
| A) Cl2 | 1) HF, NaOH, CaCO3 |
| Б) SiO2 | 2) HCl, Al2O3, CaCl2 |
| B) K2CO3 | 3) LiOH, KI, BaCl2 |
| Г) Fe2(SO4)3 | 4) H2SO4, O2, CO2 |
| 5) Mg, H2S, H2O |

























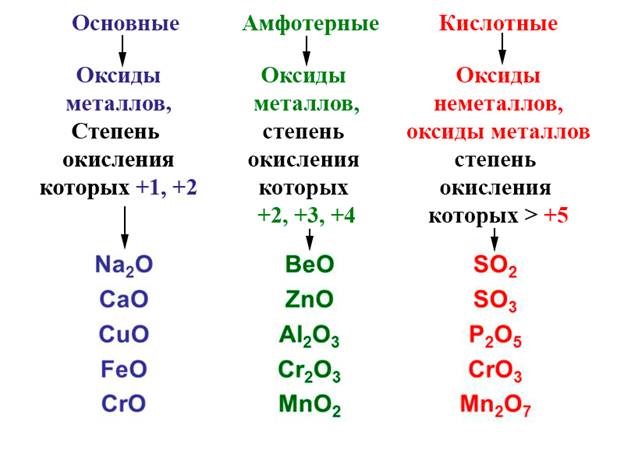
 Определяем типы оксидов, исключаем варианты согласно таблице выше.
Определяем типы оксидов, исключаем варианты согласно таблице выше.