Электроотрицательность, степень окисления и валентность химических элементов
Оглавление
Электроотрицательность
В химии широко применяется понятие электроотрицательности (ЭО) — свойство атомов данного элемента оттягивать на себя электроны от атомов других элементов в соединениях называют электроотрицательностью. Электроотрицательность лития условно принимается за единицу, ЭО других элементов вычисляют соответственно. Имеется шкала значений ЭО элементов.
Числовые значения ЭО элементов имеют приблизительные значения: это безразмерная величина. Чем выше ЭО элемента, тем ярче проявляются его неметаллические свойства. По ЭО элементы можно записать следующим образом:
F > O > Cl > Br > S > P > C > H > Si > Al > Mg > Ca > Na > K > Cs

Наибольшее значение ЭО имеет фтор. Сопоставляя значения ЭО элементов от франция (0,86) до фтора (4,1), легко заметить, что ЭО подчиняется Периодическому закону. В Периодической системе элементов ЭО в периоде растет с увеличением номера элемента (слева направо), а в главных подгруппах — уменьшается (сверху вниз). В периодах по мере увеличения зарядов ядер атомов число электронов на внешнем слое увеличивается, радиус атомов уменьшается, поэтому легкость отдачи электронов уменьшается, ЭО возрастает, следовательно, усиливаются неметаллические свойства.

Разность электроотрицательностей элементов в соединении (ΔX) позволит судить о типе химической связи.
Если величина Δ X = 0 – связь ковалентная неполярная.
При разности электроотрицательностей до 2,0 связь называют ковалентной полярной, например: связь H—F в молекуле фтороводорода HF: Δ X = (3,98 – 2,20) = 1,78
Связи с разностью электроотрицательностей больше 2,0 считаются ионными. Например: связь Na—Cl в соединении NaCl: Δ X = (3,16 – 0,93) = 2,23.
Электроотрицательность зависит от расстояния между ядром и валентными электронами, и от того, насколько валентная оболочка близка к завершенной. Чем меньше радиус атома и чем больше валентных электронов, тем выше его ЭО.
Фтор является самым электроотрицательным элементом. Во-первых, он имеет на валентной оболочке 7 электронов (до октета недостает всего 1-го электрона) и, во-вторых, эта валентная оболочка расположена близко к ядру.
 Менее всего электроотрицательны атомы щелочных и щелочноземельных металлов. Они имеют большие радиусы и их внешние электронные оболочки далеки от завершения. Им гораздо проще отдать свои валентные электроны другому атому (тогда предвнешняя оболочка станет завершенной), чем “добирать” электроны.
Менее всего электроотрицательны атомы щелочных и щелочноземельных металлов. Они имеют большие радиусы и их внешние электронные оболочки далеки от завершения. Им гораздо проще отдать свои валентные электроны другому атому (тогда предвнешняя оболочка станет завершенной), чем “добирать” электроны.
Электроотрицательность можно выразить количественно и выстроить элементы в ряд по ее возрастанию. Наиболее часто используют шкалу электроотрицательностей, предложенную американским химиком Л. Полингом.
 Степень окисления
Степень окисления
Сложные вещества, состоящие из двух химических элементов, называют бинарными (от лат. би — два), или двухэлементными (NaCl, HCl). В случае ионной связи в молекуле NaCl атом натрия передает свой внешний электрон атому хлора и превращается при этом в ион с зарядом +1, а атом хлора принимает электрон и превращается в ион с зарядом —1. Схематически процесс превращения атомов в ионы можно изобразить так:

При химическом взаимодействии в молекуле HCl общая электронная пара смещается в сторону более электроотрицательного атома. Например, , т. е. электрон не полностью перейдет от атома водорода к атому хлора, а частично, обусловливая тем самым частичный заряд атомов δ: Н+0.18Сl-0.18. Если же представить, что и в молекуле HCl, как и в хлориде NaCl, электрон полностью перешел от атома водорода к атому хлора, то они получили бы заряды +1 и -1:
, т. е. электрон не полностью перейдет от атома водорода к атому хлора, а частично, обусловливая тем самым частичный заряд атомов δ: Н+0.18Сl-0.18. Если же представить, что и в молекуле HCl, как и в хлориде NaCl, электрон полностью перешел от атома водорода к атому хлора, то они получили бы заряды +1 и -1:

Такие условные заряды называют степенью окисления. При определении этого понятия условно предполагают, что в ковалентных полярных соединениях связующие электроны полностью перешли к более электроотрицательному атому, а потому соединения состоят только из положительно и отрицательно заряженных атомов.
Степень окисления — это условный заряд атомов химического элемента в соединении, вычисленный на основе предположения, что все соединения (и ионные, и ковалентно-полярные) состоят только из ионов. Степень окисления может иметь отрицательное, положительное или нулевое значение, которое обычно ставится над символом элемента сверху, например:
Отрицательное значение степени окисления имеют те атомы, которые приняли электроны от других атомов или к которым смещены общие электронные пары, т. е. атомы более электроотрицательных элементов. Положительное значение степени окисления имеют те атомы, которые отдают свои электроны другим атомам или от которых оттянуты общие электронные пары, т. е. атомы менее электроотрицательных элементов. Нулевое значение степени окисления имеют атомы в молекулах простых веществ и атомы в свободном состоянии, например:
В соединениях суммарная степень окисления всегда равна нулю.
 Валентность
Валентность
Валентность атома химического элемента определяется в первую очередь числом неспаренных электронов, принимающих участие в образовании химической связи.
Валентные возможности атомов определяются:
• числом неспаренных электронов (одноэлектронных орбиталей);
• наличием свободных орбиталей;
• наличием неподеленных пар электронов.
В органической химии понятие «валентность» замещает понятие «степень окисления», с которым привычно работать в неорганической химии. Однако это не одно и то же. Валентность не имеет знака и не может быть нулевой, тогда как степень окисления обязательно характеризуется знаком и может иметь значение, равное нулю.
В основном, под валентностью понимается способность атомов к образованию определённого числа ковалентных связей. Если в атоме имеется n неспаренных электронов и m неподелённых электронных пар, то этот атом может образовывать n + m ковалентных связей с другими атомами, т.е. его валентность будет равна n + m. При оценке максимальной валентности следует исходить из электронной конфигурации «возбуждённого» состояния. Например, максимальная валентность атома бериллия, бора и азота равна 4.
Постоянные валентности:
- H, Na, Li, К, Rb, Cs — Степень окисления I
- О, Be, Mg, Ca, Sr, Ba, Ra, Zn, Cd — Степень окисления II
- B, Al, Ga, In — Степень окисления III
Переменные валентности:
- Сu — I и II
- Fe, Со, Ni — II и III
- С, Sn, Pb — II и IV
- P— III и V
- Cr — II, III и VI
- S — II, IV и VI
- Mn—II, III, IV, VI и VII
- N—II, III, IV и V
- Cl—I, IV, VI и VII
Используя валентности можно составить формулу соединения.
Химическая формула — это условная запись состава вещества посредством химических знаков и индексов.
Например: Н2O-формула воды, где Н и О-химические знаки элементов, 2 — индекс, который показывает число атомов данного элемента, входящих в состав молекулы воды.
При названии веществ с переменной валентностью обязательно указывается его валентность, которая ставится в скобки. Например, Р205— оксид фосфора (V)
I. Степень окисления свободных атомов и атомов в молекулах простых веществ равна нулю — Na0, Р40, О20
II. В сложном веществе алгебраическая сумма СО всех атомов с учётом их индексов равна нулю = 0. а в сложном ионе его заряду.
Например:
Разберем для примера несколько соединений и узнаем валентность хлора:
Справочный материал для прохождения тестирования:




























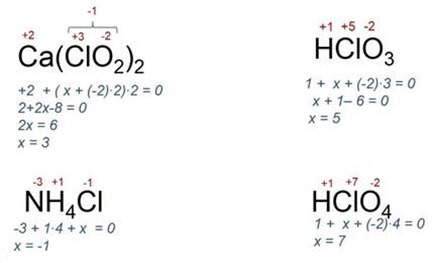










Странно, в вашем тесте есть неточные ответы. Вы сами себе противоречите. Хлор проявляет положительную степень окисления в соединении с
серой
водородом
кислородом
железом
Неправильный ответ на вопрос
Баллов: 0 из 1
Правильный ответ:
водородом
Комментарий:
Хлор проявляет положительную степень окисления в соединении с элементами с большей электроотрицательностью (F, O, N).