Свойства соединений неметаллов
Оглавление
- Вода
- Пероксид водорода
- Галогеноводородные кислоты
- Кислородсодержащие соединения галогенов
- Применение галогенов и их соединений
- Озон
- Сероводород
- Сульфиды
- Полисульфиды
- Оксид серы (IV)
- Оксид серы (VI)
- Серная кислота
- Химические свойства серной кислоты
- Применение серной кислоты и ее солей
- Серосодержащие соли
- Аммиак
- Физические и химические свойства аммиака
- Донорно-акцепторный механизм образования иона аммония
- Получение аммиака
- Соли аммония
- Оксиды азота
- Азотная кислота
- Соли азотной кислоты
- Соединения фосфора
- Фосфин
- Оксиды фосфора
- Галогениды фосфора
- Фосфорные кислоты
- Оксиды углерода
- Угольная кислота и ее соли
- Соли угольной кислоты
- Оксиды кремния
- Карбиды и силициды
- Шпаргалки
- Задания для самопроверки
Вода
Из огромного числа соединений водорода здесь мы обсудим свойства только его оксида (воды) и пероксида (перекиси водорода).
Вода. Вода — самое распространенное соединение на Земле. Масса воды на Земле оценивается в 1018 т. Водой покрыто приблизительно четыре пятых земной поверхности. Это единственное вещество, которое в природных условиях существует в трех агрегатных состояниях: жидкость, твердое вещество (лёд) и газ (водяной пар). Вода широко используется в промышленности, быту и в лабораторной практике; она необходима для поддержания жизни. Приблизительно две трети массы человеческого тела приходится на долю воды; во многих пищевых продуктах весьма большое содержание воды.
Вода — ковалентное соединение. В природе вода всегда загрязнена различными солями, растворенными в ней. Для очистки от примесей воду «перегоняют», полученный продукт называют дистиллированной водой.
Чистая вода — бесцветная жидкость (газ или лёд), не имеет запаха, но с особым вкусом. Редкая особенность воды состоит в том, что ее плотность в жидком состоянии при 4 °С больше плотности льда, поэтому лёд плавает на поверхности воды. Это аномальное свойство воды объясняется образованием водородных связей между молекулами воды как в жидком, так и в твердом состоянии. Поскольку молекула воды обладает значительным дипольным моментом, вода — хороший растворитель для веществ с ионными и полярными связями. Растворение веществ в воде сопровождается гидратацией. Водные растворы многих веществ проводят электрический ток; такие вещества называются электролитами. Чистая вода — слабый электролит и плохо проводит электрический ток.
Вода участвует во множестве химических реакций в качестве растворителя, реагента либо продукта. Здесь мы обсудим важнейшие химические реакции, в которых вода участвует в качестве реагента.
1. Кислотно-основные реакции. Вода обладает амфотерными свойствами. Это означает, что она может выступать как в роли кислоты, например:
NH3 + Н2O ⇆ NH3•Н2O ⇆ NH4+ + ОН—
ВаО + Н2O = Ва(ОН)2
так и в роли основания, например:
Р2O5 + 3Н2O = 2Н3РO4
2. Вода воздействует гидролитически на многие соли, образуя либо гидраты (гидратная вода в кристаллах солей называется кристаллизационной):
СаСl2 + 6Н2O = СаСl2 • 6Н2O
либо продукты гидролиза:
Al2S3 + 6Н2O = 2Al(OH)3↓ + 3H2S↑
Гидролиз органических соединений — также распространенный процесс. Один из самых известных примеров — гидролиз сложных эфиров.
3. Вода окисляет металлы, расположенные в электрохимическом ряду напряжений до олова. Например, с щелочными металлами вода бурно реагирует на холоде:
2К + Н2O = 2КОН + Н2↑
с алюминием (предварительно очищенным от оксидной пленки) — при кипячении:
2Аl + 6Н2O = 2Аl(ОН)3 + ЗН2↑
с железом — в виде пара при сильном нагревании:
3Fe + 4Н2O ⇆ Fe3O4 + 4H2↑
Пероксид водорода
Пероксид водорода (перекись водорода) Н2O2. Это тяжелая полярная жидкость голубоватого цвета. Строение молекулы Н2O2 показано на рисунке.
В жидком состоянии молекулы пероксида водорода сильно ассоциированы благодаря водородным связям. Поскольку по сравнению с водой пероксид водорода имеет больше возможностей для образования водородных связей, у пероксида водорода более высокие плотность, вязкость и температура кипения (150,2 °С). Пероксид водорода смешивается с водой во всех соотношениях. Чистый Н2О2 и весьма концентрированные растворы взрываются на свету. Для технических целей выпускают растворы пероксида разной концентрации; 30%-й раствор пероксида водорода в воде, стабилизированный добавлением фосфатов, называется «пергидроль».
Пероксид водорода каталитически разлагается при комнатной температуре, выделяя в первый момент атомарный кислород. На этом основано использование 3%-го раствора Н2О2 в медицине. Пероксид водорода вступает в реакции трех типов.
- Без изменения пероксидной группировки:
Ва(ОН)2 + Н2O2 = ВаO2 + 2Н2O
- В качестве восстановителя:
2КМnО4 + 5Н2О2 + 3H2SО4 = 2MnSО4 + K2SО4 + 5О2 + 8Н2О
- В качестве окислителя, что более характерно:
PbS + 4Н2О2 = PbSО4 + 4Н2О
В лаборатории пероксид водорода обычно получают действием разбавленной серной кислоты на пероксид бария.
ВаO2 + H2SО4 = BaSО4↓ + Н2О2
Пероксид водорода имеет разные применения: в производстве отбеливателей, вводимых в синтетические моющие средства; для получения различных пероксидов, особенно в органической химии; в реакциях полимеризации; для получения антисептических средств; для реставрации живописи на основе свинцовых красок.
Галогеноводородные кислоты
Все галогеноводороды (общую формулу можно записать как НГ) — бесцветные газы, с резким запахом, токсичны. Очень хорошо растворяются в воде и дымятся во влажном воздухе, т. к. притягивают находящиеся в воздухе водяные пары, образуя при этом туманное облако.
Галогеноводороды, галогеноводородные кислоты и галогениды.
Все галогеноводороды при обычных условиях — газы. Химическая связь в их молекулах — ковалентная полярная, причем полярность связи в ряду
HF — НСl — НВг — HI
уменьшается. Прочность связи также уменьшается в этом ряду. Вследствие полярности все галогеноводороды, в отличие от галогенов, очень хорошо растворимы в воде. Так, при комнатной температуре в 1 объеме воды можно растворить около 400 объемов НСl, 530 объемов НВг и около 400 объемов HI. Фтороводород HF и хлороводород НСl получают действием концентрированной (безводной!) серной кислоты на твердые галогениды:
KF + H2SO4{конц) = HF↑+KHSO4
КСl + H2SO4(конц) = HCl↑ + KHSO4
Самая сильная из галогеноводородных кислот — йодоводородная, а самая слабая — фтороводородная. Большая прочность химической связи H—F (поэтому фтороводородная кислота слабо диссоциирует в воде) обусловлена малым размером атома F и соответственно малым расстоянием между ядрами атомов водорода и фтора. С ростом радиуса атома от F к I растет и расстояние H—F, прочность молекул уменьшается и, соответственно, способность к электролитической диссоциации увеличивается. Наиболее технически важным являются хлороводород и соляная кислота. В промышленности хлороводород получают синтезом из водорода и хлора:
В лабораторных условиях для получения HCl используют реакцию, проводимую при нагревании:
Необратимому протеканию этой реакции способствует летучесть HCl. Соляная кислота представляет собой бесцветную, дымящуюся на воздухе жидкость, она несколько тяжелее воды. Это типичная кислота, взаимодействует с металлами, оксидами металлов, основаниями и солями. Соляная кислота находит широкое применение в промышленности страны. Ее используют для получения солей, при паянии, для очистки поверхности металлов в гальваностегии, при производстве красок, приготовлении лекарственных препаратов, а также пластмасс и других синтетических материалов.
В аналогичной реакции получить НВr и HI не удается, так как они — сильные восстановители и окисляются концентрированной серной кислотой. Их получают гидролизом галогенидов фосфора, образующихся при взаимодействии красного фосфора с бромом (или с йодом).
2Р + 3Br2 + 6Н2O = 6HBr↑ + 2Н3РO3
При растворении галогеноводородов в воде происходит диссоциация на ионы и образуются растворы галогеноводородных кислот. В растворах HI, НВr и НС1 происходит почти полная их диссоциация, поэтому соответствующие кислоты относятся к сильным. В отличие от них фтороводородная (плавиковая) кислота слабая. Аномальные свойства плавиковой кислоты объясняются ассоциацией молекул HF вследствие возникновения между ними водородных связей. Это объясняет еще одну особенность плавиковой кислоты — образовывать при определенных условиях кислые соли.
Отрицательные ионы галогеноводородных кислот могут про являть только восстановительные свойства, поэтому при взаимодействии этих кислот с металлами окисление последних может происходить только под действием ионов Н+. Кислоты HHal реагируют только с металлами, стоящими в ряду напряжений левее водорода.
Все галогениды металлов, за исключением галогенидов серебра и свинца, хорошо растворимы в воде. Малая растворимость галогенидов серебра позволяет использовать обменную реакцию их образования как качественную на галогенид-ионы: AgCl — белый осадок, AgBr — желтовато-белый осадок, AgI — ярко-желтый осадок.
Ag+ + Hal— = AgHal↓
Интересно, что по сравнению с другими солями растворимость хлорида натрия в воде сравнительно мала. Из-за этого хлорид натрия выпадает в осадок при смешивании насыщенных растворов нитрата натрия и хлорида кальция:
2NaNO3(насыщ.) + CaCl2(насыщ.) = 2NaCl(T)↓ + Ca(NO3)2(p-p)
Плавиковая кислота взаимодействует с оксидом кремния(IV), в отличие от других галогеноводородных кислот, которые в эту реакцию не вступают.
SiO2 + 4HF = SiF4↑ + 2H2O
Оксид кремния(IV) входит в состав стекла, а плавиковая кислота разъедает стекло. Поэтому плавиковую кислоту получают (и хранят) в сосудах из полиэтилена или тефлона.
Необходимо отметить очень важную особенность галогенидов серебра — все они неустойчивы на солнечном свету, разлагаясь на серебро и свободный галоген.
2AgHal(т) → hv → 2Ag(т) + Hal2
Именно реакции типа привели к созданию черно-белой фотографии. Чаще всего в фотографии используют наиболее чувствительный бромид серебра.
В фотоматериалах обычно используется светочувствительная суспензия AgBr в желатине, нанесенная тонким слоем на целлулоидную пленку, бумагу или стекло. При экспозиции в тех местах светочувствительного слоя, где на него попал свет, образуются мельчайшие зародыши кристаллов металлического серебра. Это «скрытое» изображение фотографируемого объекта. При проявлении бромид серебра разлагается, причем скорость разложения тем больше, чем больше концентрация зародышей в данном месте слоя. Получается видимое изображение, которое является обращенным, или негативным, поскольку почернение в каждой точке светочувствительного слоя тем больше, чем выше была его освещенность при экспозиции. В ходе закрепления (фиксации) из светочувствительного слоя необходимо удалить неразложившийся бромид серебра. Это происходит при взаимодействии AgBr с веществом закрепителя — тиосульфатом натрия:
AgBr + 2Na2S2O3 = Na3[Ag(S2O3)2] + NaBr
Далее негатив проецируют на фотобумагу и подвергают действию света — «печатают» фотографию. При этом наиболее освещенными оказываются те места фотобумаги, которые находятся против светлых мест негатива. Поэтому при фотопечати «светлые»-«темные» области меняются на обратную картинку, которая соответствует реальному сфотографированному объекту. Фотография это «позитивное» изображение.
Кислородсодержащие соединения галогенов
Все галогены, кроме фтора, образуют соединения, в которых они имеют положительную степень окисления. Важное значение имеют кислородсодержащие кислоты галогенов с общей формулой ННаlOn (n = 1 — 4) и соответствующие им соли и ангидриды. Такие соединения наиболее характерны для хлора, для которого известны четыре кислородсодержащие кислоты.
Сила кислот в ряду НСlО — НСlO4, изменяется весьма существенно.
При сравнении окислительной способности вещества всегда нужно учитывать реальные условия протекания реакции. Например, утверждение, что в ряду кислот НСlO — НСlO2 —HClO3 — HClO4), окислительная активность уменьшается от НСlO к НСlO4, верно только для обычных условий (комнатная температура, действие света). Здесь решающее значение имеет не окислительная способность хлора в положительной степени окисления, а атомарный кислород, выделяющийся при распаде неустойчивых кислот, устойчивость которых на свету как раз возрастает от НСlO к НСlO4. Если же сравнивать окислительную способность этих кислот в других уcловиях — в темноте, при более низких температурах, окислительная способность возрастает от НСlO к НСlO4.
Из солей кислородсодержащих кислот широко известны бертолетова соль (хлорат калия) КСlO3 и хлорная («белильная») известь.
Хлорную известь получают действием хлора на гидроксид кальция.
2Сl2 + 2Са(ОН)2 = СаСl2 + Са(ОСl)2 + 2Н2О
Полученную смесь солей называют хлорной известью. Формально суммируя состав хлорной извести, получим формулу СаОС12, а на самом деле это смешанная соль — хлорид-гипохлорит кальция.
Хлорная известь — белый порошок с резким запахом; она обладает сильными окислительными свойствами. Под действием влажного воздуха, содержащего углекислый газ, хлорная известь превращается в хлорноватистую кислоту.
2СаОСl2 + СO2 + Н2O = СаСO3 + СаСl2 + 2НОСl
При действии на хлорную известь соляной кислоты выделяется хлор.
СаОСl2 + 2НСl = СаСl2 + Сl2 + Н2O
Применение галогенов и их соединений
Фтор используют для получения различных фторпроизводных углеводородов, обладающих уникальными свойствами. Например, тефлон проявляет исключительную устойчивость к химическим реагентам. Ранее фтор шел на синтез фреонов (хладоагентов, например CCl2F2). Жидкий фтор как один из самых эффективных окислителей используют в ракетных топливах. Большие количества HF используются при получении различных фторидов, применяемых, например, в зубных пастах.
Хлорорганические соединения используются в производстве пластмасс, синтетического волокна, растворителей. Газообразный хлор применяют в производстве соляной кислоты, брома, хлорной извести, гипохлоритов, хлоратов. Большие количества хлора используют для обеззараживания воды и отбеливания тканей, хлорирования органических продуктов. Для отбеливания тканей, дерева, целлюлозы используют также соли NaOCl и СаОС12. Из хлорорганических соединений изготавливают различные пластмассы, синтетические волокна, растворители. Соляная кислота широко применяется в химической практике. Ежегодное мировое производство соляной кислоты исчисляется миллионами тонн.
Иод в виде простого вещества, а также соединения с другими галогенами применяют в медицине. Бромид и йодид серебра в больших количествах идут на изготовление фотоматериалов (причем йодид используется в цветной фотографии).
С развитием техники области применения некоторых веществ непрерывно расширяются, часто в самом неожиданном направлении. Так, например, в последние десятилетия йд стал предметом пристального внимания физиков, занимающихся созданием лазеров. В результате создан так называемый фотодиссоционный йодный лазер. Еще более мощные, так называемые химические лазеры, созданы на основе газовой смеси (Н2 + F2).
Озон
Озон O3 — еще более сильный окислитель, чем кислород O2. Он образуется в атмосфере при грозовых разрядах (этим объясняется специфический запах свежести после грозы). Обычно озон получается из кислорода воздуха в озонаторах в условиях газового разряда между двумя проводниками, на которые подается высокое напряжение; реакция образования озона эндотермическая, обратимая; выход озона около 5%.
3О2 ⇆ 2О3 — 284 кДж
При взаимодействии озона с раствором йодида калия выделяется йод, тогда как с кислородом реакция не идет.
2KI + О3 + Н2О = I2 + 2КОН + О2
Эта реакция часто используется как качественная для обнаружения ионов I— или озона, причем в раствор добавляют крахмал, который дает характерный синий комплекс с йодом. Озон не окисляет ионы Сl— и Вг—.
При пропускании газообразного озона через раствор алкена в тетрахлорметане при температуре ниже 20 °С образуется озонид.
Озониды неустойчивы. Они подвергаются гидролизу с образованием альдегидов или кетонов:
Метаналь (формальдегид) частично реагирует с пероксидом водорода, образуя метановую (муравьиную) кислоту.
HCHO + H2O2 → HCOOH + H2O.
Сероводород
Сероводород H2S — бесцветный газ с резким запахом. Очень ядовит. Вызывает отравление даже при незначительном содержании в воздухе (около 0,01 %). Сероводород опасен тем, что может накапливаться в организме. Он соединяется с гемоглобином крови, что может привести к обморочному состоянию и смерти от кислородного голодания. В присутствии паров органических веществ токсичность H2S резко возрастает.
Вместе с тем H2S имеет лечебное значение, он является составной частью некоторых минеральных вод. При растворении сероводорода в воде образуется слабая сероводородная кислота, соли которой называются сульфидами. Сульфиды щелочных и щелочноземельных металлов, а также сульфид аммония хорошо растворяются в воде, сульфиды остальных металлов нерастворимы и окрашены в различные цвета, например, ZnS — белый, PbS — черный, MnS — розовый.
При нагревании серы в токе водорода происходит обратимая реакция с очень малым выходом сероводорода. Обычно в лаборатории сероводород получают действием разбавленных кислот на сульфиды.
FeS + 2HCl = FeCl2 + H2S↑
Другой способ получения сероводорода заключается в добавлении холодной воды к сульфиду алюминия.
Al2S3(т) + 6Н2O(Ж) = 2Аl(ОН)3↓ + 3H2S↑
Сероводород, полученный этим способом, чище, чем в реакции с кислотой.
Сероводород — ковалентное соединение. Геометрия его молекулы похожа на воду. Однако, в отличие от воды, между молекулами сероводорода не образуется водородных связей. Дело в том, что атом серы менее электроотрицателен, чем атом кислорода, и большего размера. Поэтому на сере в сероводороде плотность заряда меньше, чем на кислороде в молекуле воды. Из-за отсутствия водородных связей у сероводорода более низкая температура кипения, чем у воды. По этой же причине сероводород плохо растворим в воде: в 1 объеме воды растворяется только 3 объема сероводорода.
Сероводород горит. Сероводород — типичный восстановитель. В кислороде он горит, легко окисляется галогенами. При охлаждении пламени (внесении в него холодных предметов) осаждается свободная сера:
Если же пламя не охлаждать и обеспечить избыток кислорода, то получается оксид серы (IV):
Сероводород легко окисляется галогенами:
H2S + Br2 = S↓ +2НВг
Водный раствор сероводорода — очень слабая кислота, которая диссоциирует ступенчато.
H2S⇆ Н+ + HS (К1 = 6 • 10-8)
HS ⇆ Н+ + S2- (К2 = 1 • 10-14)
Как и газообразный сероводород, сероводородная кислота — типичный восстановитель и окисляется сильными окислителями, например хлором:
H2S + 4Сl2 + 4Н2O = H2SO4 + 8НСl
и более слабыми окислителями, например сернистой кислотой H2SO3 и диоксидом серы SO2,
2H2S + H2SO3 = 3S↓ + 3H2O
и даже ионами трехвалентного железа
2FeCl3 + H2S = 2FeCl2 + S↓ + 2HCl
Сульфиды
Сероводородная кислота может реагировать с основаниями, основными оксидами или солями, образуя два ряда солей: средние — сульфиды, кислые — гидросульфиды. Большинство сульфидов (за исключением сульфидов аммония, щелочных и щелочноземельных металлов) плохо растворяется в воде (см. таблицу растворимости). Например, при пропускании сероводорода через раствор, содержащий ионы свинца РЬ2+, образуется черный осадок сульфида свинца.
Pb2+ + H2S = PbSi + 2Н+
Эту реакцию используют для обнаружения сероводорода или сульфид-ионов.
Давайте обсудим, почему возможна реакция образования сульфида из свинцовых белил, если сероводородная кислота слабее угольной; сравните константы диссоциации H2S и Н2СO3. Мы ведь до сих пор считали, что только сильная кислота вытесняет слабую из ее солей, однако в этом случае, по-видимому, влияют факторы, которые оказались более существенными. Для гетерогенных реакций важное значение имеют растворимости; растворимость PbS меньше растворимости [РЬ(OН)]2СO3 в миллионы раз, поэтому равновесие обсуждаемой реакции и смещено вправо.
PbS — рекордсмен по «нерастворимости». Кроме того, многие сульфиды как соли очень слабой кислоты подвергаются гидролизу.
Полисульфиды
Сера может образовывать полисульфиды; лучше других изучены дисульфиды щелочных металлов и аммония, легко образующиеся при нагревании растворов сульфидов с серой.
K2S + S = K2S2
Хорошо известный минерал пирит FeS2 — представитель дисульфидов. В природе минерал пирит встречается в виде рудных залежей железного колчедана. Дисульфид железа(И) образует золотисто-желтые кристаллы. В лаборатории FeS2 обычно получают прокаливанием FeClg в токе сероводорода.
2FeCl3 + 2H2S = FeS2 + FeCl2 + 4HCl↑
Как в сульфидах, так и в дисульфидах сера имеет валентность II, степени окисления в этих соединениях различны: в сульфидах степень окисления серы -2, в дисульфидах -1.
Оксид серы (IV)
Оксид серы (IV) SO2, который часто называют также сернистым газом, образуется при горении серы, полном сгорании сероводорода и обжиге сульфидов. Это бесцветный газ с характерным резким запахом. Он проявляет типичные свойства кислотных оксидов и хорошо растворяется в воде, образуя слабую сернистую кислоту. Она неустойчива и разлагается на исходные вещества:
Соли сернистой кислоты, как двухосновной, могут быть средними — сульфитами, например сульфит натрия Na2SO3, и кислыми — гидросульфитами, например гидросульфит натрия NaHSO3. Гидросульфит и сульфит натрия, как и сернистый газ, используют для отбеливания шерсти, шелка, бумаги и соломы, а также в качестве консервирующих средств для сохранения свежих плодов и фруктов.
Оксид cepы(IV) образуется при сгорании серы на воздухе, но может быть также получен при горении H2S или при взаимодействии меди, а также других металлов с концентрированной серной кислотой.
Сu + 2H2SO4(конц) = CuSO4 + SO2↑ + 2Н2О
Оксид cepы(IV) получают также при обжиге сульфидных минералов, например сульфида цинка или дисульфида железа.
2ZnS + 3O2 = 2ZnO + 2SO2↑
4FeS2 + 11O2 = 2Fe2O3 + 8SO2↑
Оксид серы(IV) — ангидрид сернистой кислоты H2SO3. При растворении SO2 в воде (при 20 °С 40 объемов SO2 в 1 объеме воды) происходит обратимая реакция с водой и образуется слабая сернистая кислота:
SO2 + H2O ⇆ H2SO3
Сернистая кислота малоустойчивая, легко разлагается на SO2 и Н2O. В водном растворе сернистой кислоты существуют следующие равновесия:
Константа диссоциации H2SO3 по первой ступени = 1,6*10-2, по второй К2 = 6,3-10-8. Кислота дает два ряда солей: средние — сульфиты и кислые — гидросульфиты.
Химические реакции, характерные для SO2, сернистой кислоты и ее солей, можно разделить на четыре группы.
- Реакции, протекающие без изменения степени окисления, например:
Са(ОН)2 + SO2 = CaSO3 + Н2O
- Реакции с повышением степени окисления серы от +4 до +6, например:
Na2SO3 + Сl2 + Н2O = Na2SO4 + 2НСl
- Реакции с понижением степени окисления серы, например уже отмеченное выше взаимодействие SO2 с H2S.
- Реакции самоокисления-самовосстановления серы возможны и при ее взаимодействии с сульфитами. Так, при кипячении раствора Na2SOs с мелкоизмельченной серой образуется тиосульфат (иногда его называют гипосульфитом) натрия:
Na2SO3 + S = Na2S2O3
Тиосульфат-ион — соль тиосерной кислоты. Тиосульфат натрия содержит два атома серы в разных степенях окисления и проявляет восстановительные. Тиосульфат натрия применяют в фотографии как закрепитель, в текстильной промышленности — для удаления остатков хлора после отбеливания тканей.
Итак, SO2, сернистая кислота и ее соли могут проявлять как окислительные, так и восстановительные свойства.
Оксид серы (VI)
Оксид cepы (VI) SO3 — ангидрид серной кислоты; при комнатной температуре это бесцветная жидкость, затвердевающая уже при ~17 °С (tпл = 16,8 °С; tкип = 45 °С).
Оксид серы(VI) получают окислением SO2 только в присутствии катализатора (Pt или V2O5) и при высоком давлении.
t, р, кат.
2SO2 + O2 ⇆ 2SO3 + Q
Необходимость использования катализатора в этой обратимой реакции обусловлена тем, что сместить равновесие вправо, в сторону SO3, можно только при понижении температуры (это экзотермическая реакция), однако при низких температурах сильно уменьшается скорость реакции. Поэтому, как и в случае синтеза аммиака, здесь также при
ходится искать компромиссное решение. Для оптимального сдвига равновесия вправо требуется низкая температура, а для достижения удовлетворительной скорости реакции — высокая температура. На практике процесс проводят при температуре 400-450 °С.
Оксид cepы(VI) энергично соединяется с водой, образуя серную кислоту (маслянистая жидкость с t = 10 °С) (в производстве серной кислоты для поглощения SO3 используют концентрированную H2SO4).
SO3 + Н2O = H2SO4
SO3 хорошо растворяется в 100%-й серной кислоте. Раствор SO3 в 100%-й серной кислоте называют олеумом.
Серная кислота
При окислении оксида серы (IV) образуется оксид серы (VI):
Реакция начинается при относительно высоких температурах 420 — 650 °С и протекает в присутствии катализатора (платины, оксидов ванадия, железа и т. д.). Оксид SO3 представляет собой бесцветную, сильно дымящуюся на воздухе жидкость. Этот типичный кислотный оксид, растворяясь в воде, образует серную кислоту:
Химически чистая серная кислота — бесцветная маслянистая тяжелая жидкость. Обладает сильным гигроскопическим (водоотнимающим) свойством, поэтому применяется для осушения газов. Концентрированная серная кислота хорошо растворяет оксид серы (VI), раствор SO3 в серной кислоте называется олеумом. Правило разбавления серной кислоты: нельзя приливать воду к кислоте, следует осторожно, тоненькой струйкой, вливать кислоту в воду, непрерывно перемешивая раствор.
Химические свойства серной кислоты
Серная кислота — сильная двухосновная кислота. В воде она диссоциирует ступенчато, образуя гидросульфат- и сульфат-ионы.
H2SO4 ⇆ Н+ + HSO4— К1 = 1 • 103
HSO—4 ⇆ Н+ + SO42- К2 = 1,1 • 10-2
Серная кислота принимает участие во всех реакциях, характерных для кислот.
Разбавленная серная кислота окисляет только металлы, стоящие в ряду напряжений до водорода, за счет ионов Н+, например:
Zn + H2SO4(разб) = ZnSO4 + Н2
В реакциях с основаниями, щелочами и оксидами серная кислота образует сульфаты или гидросульфаты.
Разбавленная серная кислота проявляет все характерные свойства кислот: взаимодействует с металлами, стоящими в ряду напряжений до водорода, с выделением Н2, с оксидами металлов (основными и амфотерными), с основаниями и солями. Поскольку серная кислота двухосновна, она образует два ряда солей: средние — сульфаты и кислые — гидросульфаты, например, NaHSO4. Реактивом на серную кислоту и ее соли является хлорид бария BaCl2: сульфат-ионы SO42- с ионами бария Ba2+ образуют белый нерастворимый сульфат бария, выпадающий в осадок:
Концентрированная серная кислота по свойствам сильно отличается от разбавленной кислоты.
Концентрированная серная кислота очень бурно реагирует с водой с выделением большого количества теплоты. По этой причине при разбавлении серной кислоты следует всегда наливать кислоту в воду, а не наоборот. Концентрированная кислота гигроскопична, т. е. она способна поглощать влагу из воздуха. Поэтому концентрированную серную кислоту используют для осушения газов, не реагирующих с ней: газ пропускают через серную кислоту. Сродство серной кислоты к воде настолько велико, что она может служить дегидратирующим агентом; под действием концентрированной серной кислоты вещества, состоящие из углеводов, обугливаются, например кусочек сахара.
Бумага также обугливается, если на нее попадает концентрированная серная кислота, что обусловлено действием кислоты на волокна целлюлозы; этанол при нагревании с серной кислотой превращается в этилен или в простой эфир.
При взаимодействии концентрированной H2SO4 с металлами водород не выделяется, поскольку окислителем выступают уже не катионы водорода Н+, как в случае разбавленной кислоты, а сульфат-ионы SO42-. С металлами, стоящими правее водорода в ряду напряжений (медью, ртутью и др.), реакция протекает следующим образом:
Процессы окисления и восстановления, происходящие при этом, можно записать так:
При взаимодействии с металлами, находящимися в ряду напряжений до водорода, концентрированная H2SO4 восстанавливается до S, SO2 или H2S в зависимости от положения металла в ряду напряжений и условий протекания реакции, например:
Теперь понятно, что с H2SO4(конц) взаимодействуют металлы, стоящие в ряду напряжений как до водорода, так и после него. При этом водород не образуется, т. к. окислителем в такой реакции являются не катионы водорода Н+, как у разбавленной кислоты, а сульфат-ионы SO42-. Будучи нелетучей сильной кислотой, H2SO4(конц) способна вытеснять другие кислоты из их солей. Например, реакция получения хлороводорода:
Ежегодно в мире получают более 200 млн. т. серной кислоты. В промышленности ее получают так называемым контактным методом. Технология включает три стадии:
1) получение SO2 сжигани ем серы или обжигом сульфидных руд;
2) каталитическое окисление SO2 до SOs;
3) поглощение S03 96%-й серной кислотой;
при этом образуется 100%-я кислота
Поглощение оксида серы(VI) «просто» водой на практике сильно затруднено, так как SO3 начинает жадно поглощать воду, образуя мелкую воздушно капельную взвесь («туман»), которая препятствует дальнейшему поглощению. При необходимости можно растворять оксид серы(VI) в 100%-й серной кислоте и получать таким образом олеум (до 65%-й концентрации SO3 в H2SO4).
Около трети всей серной кислоты используют для производства удобрений. Еще треть потребляет химическая промышленность при производстве синтетических моющих средств, пластмасс, фторо-водорода и других реактивов. Серную кислоту применяют также в производстве тканей и лекарственных препаратов.
Применение серной кислоты и ее солей
Основными потребителями серной кислоты являются производство минеральных удобрений, металлургия, очистка нефтепродуктов. Серная кислота применяется также в производстве других кислот, моющих средств, взрывчатых веществ, лекарств, красок, в качестве электролита для свинцовых аккумуляторов.
Из солей серной кислоты наибольшее значение имеют: кристаллический сульфат натрия, или глауберова соль Na2SO4 • 10H2O, которая применяется в производстве соды, стекла, в медицине и ветеринарии; гипс CaSO4 • 2H2O и сульфат кальция используют в строительстве и медицине; сульфат бария BaSO4 незаменим в производстве бумаги, резины, белой минеральной краски, а также в медицине для рентгеноскопии желудка («бариевая каша»).
Медный купорос CuSO4 • 5H2O используется в сельском хозяйстве для борьбы с вредителями и болезнями растений.
Серосодержащие соли
Сульфат бария BaSO4 не растворяется в воде. Образование белого осадка BaSO4 используют как качественную реакцию на сульфат-ион.
Ва2+ + SO42- = BaSO4↓
При прокаливании твердые сульфаты ведут себя по-разному. Так, сульфаты щелочных металлов плавятся без разложения. Сульфаты металлов средней активности разлагаются на оксиды.
ZnSO4 = ZnO + SO3↑
При разложении сульфата железа(П) происходит внутримолекулярное окисление-восстановление.
4FeSO4 = 2Fe2O3 + 4SO2↑ + O2↑
Сульфаты тяжелых металлов разлагаются до металла.
Ag2SO4 = 2Ag↓ +SO2↑ +O2↑
HgSO4 = Hg + SO2↑ +O2↑
При взаимодействии концентрированной серной кислоты с различными металлами, как правило, происходит восстановление сульфат-иона SO2-, где степень окисления серы (+6), до SO2:
Zn + 2H2SO4(конц) = ZnSO4 + SO2↑ + 2H2O
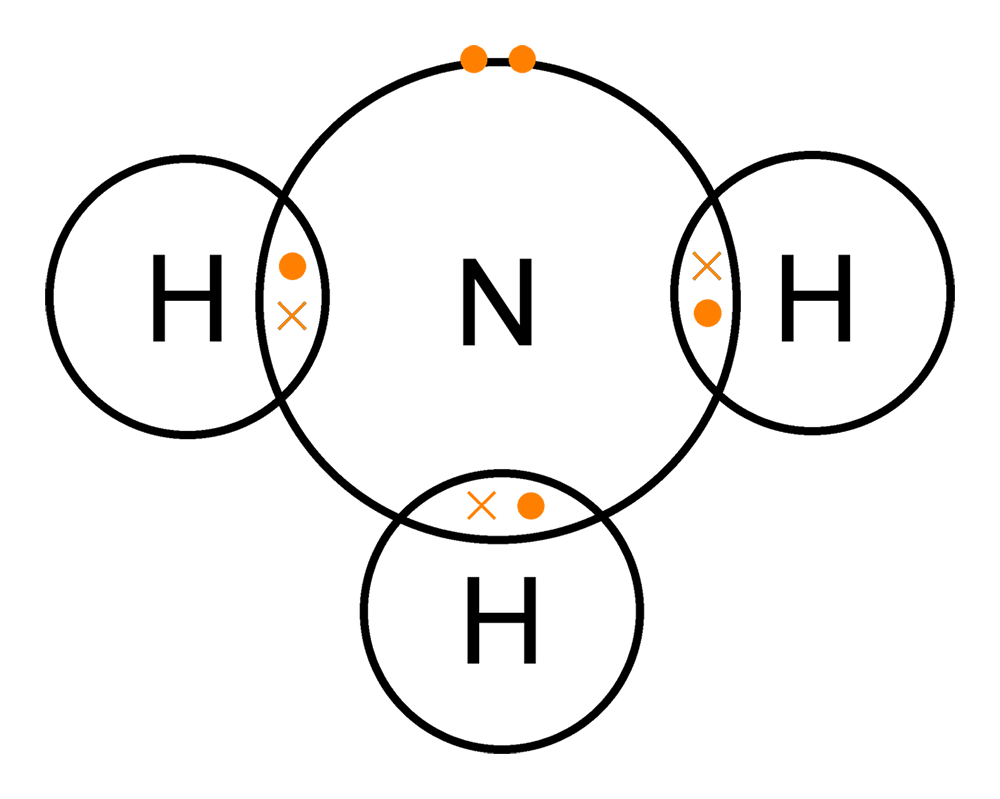
Аммиак
Известно, что на внешнем энергетическом уровне атомы азота содержат пять электронов, из которых три электрона — неспаренные. Именно они и участвуют в формировании трех ковалентных связей с тремя атомами водорода при образовании молекулы аммиака NH3:
Три общие электронные пары смещены в сторону более электроотрицательного атома азота, а поскольку молекула аммиака имеет форму треугольной пирамиды, то в результате смещения электронных пар возникает диполь, т. е. система с двумя полюсами.
Физические и химические свойства аммиака
Аммиак — бесцветный газ с резким запахом, почти в два раза легче воздуха. Этот газ легко сжижается при обычном давлении и температуре -33,4 °С, а при испарении жидкого аммиака из окружающей среды поглощается много тепла, поэтому аммиак применяется в холодильных установках. Аммиак очень хорошо растворим в воде: при 20 °С в одном объеме ее растворяется 710 объемов аммиака. Концентрированный водный раствор аммиака (25 % — по массе) называется водным аммиаком, или аммиачной водой, а используемый в медицине раствор аммиака известен под названием нашатырный спирт. Тот нашатырный спирт, который имеется в вашей домашней аптечке, содержит 10 % аммиака. Если в раствор аммиака добавить несколько капель фенолфталеина, то он окрасится в малиновый цвет, т. е. покажет щелочную среду:
Наличием гидроксид-ионов ОН— и объясняется щелочная реакция водных растворов аммиака. Если окрашенный фенолфталеином раствор аммиака подогреть, то окраска исчезнет. Аммиак взаимодействует с кислотами, образуя соли аммония. Еще одно химическое свойство аммиака можно прогнозировать, если обратить внимание на степень окисления в нем атомов азота, а именно -3. Конечно же, аммиак — сильнейший восстановитель, т. е. атомы азота могут только отдавать электроны, но не принимать их. Так, аммиак способен окислятся или до свободного азота (без участия катализатора):
или до оксида азота (II) (в присутствии катализатора):
Донорно-акцепторный механизм образования иона аммония
Водный раствор аммиака и соли аммония содержат особый ион — катион аммония NH+, играющий роль катиона металла. Он получается в результате того, что атом азота имеет свободную (неподеленную) электронную пару, за счет которой формируется еще одна ковалентная связь с катионом водорода, переходящего к аммиаку от молекул кислот или воды:
Такой механизм образования ковалентной связи, которая возникает не в результате обобществления непарных электронов, а благодаря свободной электронной паре, имеющейся у одного из атомов, называется донорно-акцепторным. В данном случае донором этой свободной электронной пары служит атом азота в аммиаке, а акцептором — катион водорода или воды.
Получение аммиака
В промышленности аммиак производят при высоких температурах и давлении синтезом в присутствии катализатора из азота и водорода:
В лаборатории аммиак получают действием гашеной извести Ca(OH)2 на соли аммония, чаще всего на хлорид аммония:
Газ собирают в перевернутый кверху дном сосуд, а распознают или по запаху, или по посинению влажной красной лакмусовой бумажки, или по появлению белого дыма при внесенной палочке, смоченной соляной кислотой. Аммиак и его соли широко используются в промышленности и технике, в сельском хозяйстве, быту для производства минеральных удобрений, производства азотной кислоты, получения взрывчатых веществ, для паяния, в холодильных установках, в медицине.
Соли аммония
Соли аммония образуются катионом аммония NH+, который играет роль катиона металла, и кислотными остатками: NH4NO3 — нитрат аммония, или аммиачная селитра; (NH4)2SO4 — сульфат аммония и т. д. Все соли аммония — твердые кристаллические вещества, хорошо растворимые в воде. По ряду свойств они похожи на соли щелочных металлов, и в первую очередь на соли калия, т. к. радиусы ионов K+ и NH+ приблизительно равны.
Соли аммония получают взаимодействием аммиака или его водного раствора с кислотами. Они обладают всеми свойствами солей, обусловленными наличием кислотных остатков. Кроме того, ион аммония обусловливает другое, общее для всех солей аммония, свойство: его соли реагируют со щелочами при нагревании с выделением аммиака:
или в сокращенном виде:
Эта реакция является качественной реакцией на соли аммония, т. к. образующийся аммиак легко обнаруживается по запаху или по образованию белого дыма при реакции его с соляной кислотой.
Третья группа свойств солей аммония — это их способность разлагаться при нагревании с выделением газообразного аммиака:
В этой реакции образуется газообразный хлороводород, который улетучивается вместе с аммиаком, а при охлаждении вновь соединяется с ним, образуя соль, т. е. при нагревании в пробирке сухой хлорид аммония как бы возгоняется, но на верхних холодных стенках пробирки снова появляются белые кристаллики NH4Cl. Хлорид аммония NH4Cl используют при паянии, т. к. он очищает поверхность металла от оксидной пленки и к ней хорошо пристает припой.
Гидрокарбонат аммония NH4HCO3 и карбонат аммония (NH4)2CO3 применяют в кондитерском деле, т. к. они легко разлагаются при нагревании и образуют газы, разрыхляющие тесто и делающие его пышным, например:
Нитрат аммония NH4NO3 в смеси с порошками алюминия и угля используют в качестве взрывчатого вещества — аммонала, который применяется при разработке горных пород.
Оксиды азота
Азот образует пять оксидов со степенями окисления +1, +2, +3, +4, +5. Оксиды N2O и NO — несолеобразующие, а остальные оксиды — кислотные: N2O3 соответствует азотистая кислота HNO2, а N2O5 — азотная кислота HNO3. Оксид азота (IV) NO2 при растворении в воде образует одновременно две кислоты — HNO2 и HNO3. Оксид азота (IV) NO2 — бурый, очень ядовитый газ. Он легко получается при окислении кислородом воздуха бесцветного несолеобразующего оксида азота (II):
Оксиды N2O и NO — бесцветные газы, оксид азота(IV) NO2 — бурый газ, нередко содержится в промышленных выбросах в атмосферу, которые получили название «лисий хвост». Оксид азота(III) N2O3 — синяя жидкость, оксид азота(V) N2O5 при обычных условиях — прозрачные бесцветные кристаллы.
Часто используют тривиальное название оксида азота(I) N2O — «веселящий газ». Это название связано с тем, что вдыхание N2O в небольших дозах вызывает конвульсивный смех. В медицине оксид азота(I) раньше использовали для ингаляционного наркоза. Оксид N2O можно получить термическим разложением нитрата аммония или взаимодействием металлов с очень разбавленной азотной кислотой. Он обладает свойствами окислителя и может поддерживать горение, например, серы, углерода, фосфора.
Р4 + 10N2O = P4O10+10N2
Оксид азота(II) обычно получают действием 50%-й азотной кислоты на металлы. Кроме того, он образуется при каталитическом окислении аммиака. Оксид азота(II) очень легко окисляется на воздухе, приобретая коричневую окраску из-за образования NO2.
2NO + О2 = 2NO2
Оксиды N2O и NO не реагируют с водой и щелочами, тогда как ангидриды N2Os и N2O5 при взаимодействии с водой дают соответствующие кислоты:
N2O3 + Н2O = 2HNO2
N2O5 + H2O = 2HNO3
а при взаимодействии со щелочами — соли этих кислот.
Оксид азота(IV) NO2 в лаборатории получают при взаимодействии тяжелых металлов с концентрированной азотной кислотой при нагревании. NO2 обычно существует в равновесии со своим димером N2O4, при охлаждении образуя жидкость бледно-желтого цвета:
2NO2(г)=N2O4(ж)
При растворении в воде на холоде NO2 обратимо диспропорционирует на азотистую и азотную кислоты, где степень окисления азота +3 и +5 соответственно.
2NO2 + Н2O ⇆ HNO2 + HNO3
Поскольку образующаяся азотистая кислота неустойчива, при нагревании реакция идет по-другому:
3NO2 + Н2O = 2HNO3 + NO
Последние две реакции и реакция NO2 со щелочами иллюстрируют его двойственную окислительно-восстановительную функцию.
2NO2 + 2КОН = KNO3 + KNO2 + H2O
Если NO2 растворяется в воде в присутствии кислорода, получается только азотная кислота.
4NO2 + 2Н2О + O2 = 4HNO3
Эта реакция используется в промышленности при получении азотной кислоты.
Азотная кислота

HNO3 — бесцветная жидкость, которая «дымится» на воздухе. Азотная кислота проявляет все типичные свойства сильных кислот: взаимодействует с оксидами и гидроксидами металлов, с солями. Но вот с металлами она ведет себя по-особому — ни один из металлов не вытесняет из азотной кислоты водород, независимо от ее концентрации (для серной кислоты такое поведение характерно только в ее концентрированном состоянии). При взаимодействии с медью концентрированная азотная кислота восстанавливается до оксида азота (IV):
а разбавленная — до оксида азота (II):
Железо и алюминий при действии концентрированной HNO2 покрываются прочной оксидной пленкой, предохраняющей металл от дальнейшего окисления, т. е. кислота пассивирует их. Поэтому азотную кислоту, как и серную, можно перевозить в стальных и алюминиевых цистернах.
Азотная кислота окисляет многие органические вещества, обесцвечивает красители. При этом обычно выделяется много теплоты и вещество воспламеняется. Так, если в азотную кислоту добавить каплю скипидара, то происходит яркая вспышка, а тлеющая лучинка в ней загорается.
Азотная кислота широко применяется в химической промышленности для производства азотных удобрений, пластмасс, искусственных волокон, органических красителей и лаков, лекарств и взрывчатых веществ.
Соли азотной кислоты — нитраты — получают при действии кислоты на металлы, их оксиды и гидроксиды. Нитраты натрия, калия, кальция и аммония, называются селитрами: NaNO3 — натриевая селитра, KNO3 — калийная селитра, Ca(NO3)2 — кальциевая селитра, NH4NO3 — аммиачная селитра. Все они применяются как азотные удобрения.
Калийная селитра используется также при изготовлении черного пороха, а из аммиачной селитры готовят взрывчатое вещество аммонал. Нитрат серебра AgNO3, или ляпис, применяется в медицине для прижигания ран, язв и т. д. Почти все нитраты хорошо растворимы в воде. При нагревании они разлагаются с выделением кислорода:
С помощью концентрированной HNO3 можно растворить даже золото. Для этого нужно взять смесь из одного объема концентрированной HNO3 и трех объемов концентрированной соляной кислоты
(такую смесь называют «царской водкой»).
Au + HNO3 + ЗНCl = AuCl3 + NO + 2H2O
Действие «царской водки» объясняется тем, что концентрированная HNO3 окисляет НСl до свободного хлора, причем в реакции образуется атомарный хлор, который в момент выделения проявляет себя как очень сильный окислитель и рееагирует с золотом. Поэтому при растворении металлов в «царской водке» получаются не соли азотной кислоты, а хлориды.
Если «царская водка» содержит избыток соляной кислоты, растворение золота происходит с образованием золотохлороводородной кислоты Н[АuСl4], где степень окисления золота +3, как в хлориде золота(III).
Au + HNO3 + 4НСl = H[AuCl4] + NO + 2H2O
Соли азотной кислоты
При нагревании (прокаливании) твердых нитратов все они разлагаются с выделением кислорода (исключение — нитрат аммония), при этом их можно разделить на четыре группы.
В первую группу входят нитраты щелочных металлов, кроме лития, которые при нагревании разлагаются на нитриты и кислород.
2KNO3 = 2KNO2 + O2↑
Во второй группе — нитраты других металлов, от щелочноземельных металлов до меди включительно, они разлагаются на оксид металла, NO2 и кислород.
2Cu(NO3)2 = 2CuO + 4NO2 + O2
Нитраты тяжелых металлов (AgNO3 и Hg(NOs)2) разлагаются до свободного металла, NO2 и кислорода.
Hg(NO3)2 = Hg + 2NO2 + O2
Только нитрат аммония разлагается до оксида азота(I).
NH4NO3 = N2O + 2Н2O
Почти все нитраты хорошо растворимы в воде. Поэтому природные месторождения нитратов встречаются редко (например, натриевая селитра NaNO3 в Чили; другое название этого нитрата — чилийская селитра). Нитраты получают в основном искусственно на химических заводах из азотной кислоты и соответствующих гидроксидов.
Следует обратить внимание на одно важное свойство нитратов: в кислых растворах нитратов металлы растворяются, как в разбавленной азотной кислоте. Например, медь растворяется в таких растворах с выделением NO.
3Cu + 2KNO3 + 4H2SO4 = 3CuSO4 + K2SO4 + 2NO + 4H2O
Азотистая кислота HNO2 (К = 6*10-4 при 25 °С) принадлежит к слабым кислотам. Она неустойчива и известна лишь в разбавленных растворах, в которых существует равновесие
2HNO2 ⇆ NO + NO2 + Н2O
Нитриты, в отличие от самой кислоты, устойчивы даже при нагревании; исключение — кристаллический нитрит аммония, который при нагревании разлагается на свободный азот и воду.
Как азотистая кислота, так и ее соли содержат азот в промежуточной степени окисления +3 и поэтому в окислительно-восстановительных реакциях могут проявлять свойства или окислителей, или восстановителей.
2HNO2 + 2HI = I2 + 2NO↑ + 2Н2О
HNO2 + Н2O2 = HNO3 + Н2O
2NaNO2 + Na2S + 2H2S04 = 2Na2SO4 + S + 2NO↑ + 2H2O
5KNO2 + 2KMnO4 + 3H2SO4 = 5KNO3 + K2SO4 + 2MnSO4 + 3H2O
Нитриты — промежуточные соединения в процессе усвоения нитратного азота организмами животных и растениями.
Соединения фосфора
При горении фосфина или фосфора образуется оксид фосфора (V) Р2O5 — белый гигроскопический порошок. Это типичный кислотный оксид, обладающий всеми свойствами кислотных оксидов.
Оксиду фосфора соответствует фосфорная кислота Н3РO4. Она представляет собой твердое прозрачное кристаллическое вещество, хорошо растворимое в воде в любых соотношениях. Как трехосновная кислота Н3РO4 образует три ряда солей:
• средние соли, или фосфаты, например, Са3(РO4)2, которые нерастворимы в воде, кроме фосфатов щелочных металлов;
• кислые соли — дигидрофосфаты, например, Са(НРO4)2, большинство из которых хорошо растворимы в воде;
• кислые соли — гидрофосфаты, например, СаНРO4, которые малорастворимы в воде (кроме фосфатов натрия, калия и аммония), т. е. занимают промежуточное положение между фосфатами и гидрофосфатами по растворимости.
В природе фосфор встречается только в виде соединений. Важнейшими природными соединениями фосфора являются минералы фосфориты и апатиты. Основную их массу составляет фосфат кальция Са3(РО4)2, из которого и получают в промышленности фосфор.
Фосфин
Водородное соединение фосфора менее устойчивое, чем аммиак; это очень ядовитый газ. По своим химическим свойствам фосфин отличается от аммиака, он гораздо более сильный восстановитель. Так, на воздухе фосфин самопроизвольно воспламеняется с образованием фосфорной кислоты.
РН3 + 2O2 = Н3РO4
В отличие от аммиака фосфин РН3 почти не растворяется в воде (0,3 объема на один объем Н2O) и не образует гидроксида фосфония, что объясняется гораздо меньшей активностью неподеленной электронной пары (3s2) фосфора в фосфине по сравнению с неподеленной парой азота в NH3.
Оксиды фосфора
Фосфорный ангидрид Р2O5 («простейшая» формула) — наиболее устойчивый оксид фосфора при обычных условиях. Это твердое, белое, очень гигроскопичное вещество состава Р4О10 активно взаимодействует с водой, а также отнимает ее от других соединений, образуя в зависимости от условий либо метафосфорную НРO3, либо ортофосфорную Н3РO4, либо пирофосфорную Н4Р2O7 кислоту. Именно поэтому Р4О10 широко используется как осушитель различных веществ от паров воды.
Фосфористый ангидрид или оксид фосфора(Ш) с простейшей формулой Р2O3 в действительности димер Р4O6. Показано, что фосфор в Р4Об координационно ненасыщен и поэтому достаточно реакционно- способен. Оксид фосфора(Ш) — белое воскообразное вещество, образующееся при окислении фосфора в условиях недостатка кислорода.
Взаимодействие Р4O6 с холодной водой приводит к образованию фосфористой кислоты.
Р4О6 + 6Н2O = 4Н3РO3
Газообразный НСl разлагает Р4O6.
P4O6 + 6НСl = 2Н3РO3 + 2РСl3
Галогениды фосфора
Фосфор образует два хлорида: трихлорид фосфора РСl3 и пентахлорид фосфора РСl5.
Трихлорид фосфора РСl3 получают, пропуская хлор над поверхностью белого фосфора. При этом фосфор горит бледно-зеленым пламенем, а образующийся хлорид фосфора конденсируется в виде бесцветной жидкости.
Трихлорид фосфора гидролизуется водой с образованием двухосновной фосфористой кислоты и хлороводорода.
РСl3 + 3Н2O = Н3РO3 + 3НСl
Бледно-желтые кристаллы пентахлорида фосфора РСl5 можно получить в лабораторных условиях, либо по обратимой реакции хлора и трихлорида фосфора, проводимой при температуре около О °С, поскольку при нагревании пентахлорид фосфора диссоциирует на трихлорид фосфора и хлор.
РСl3 + Сl2 ⇆ РСl5
Пентахлорид фосфора бурно реагирует с водой, образуя фосфорную кислоту.
РСl5 + 4Н2О = Н3РO4 + 5НСl
Как пентахлорид фосфора, так и трихлорид фосфора используют как хлорирующие реагенты в органической химии. Например, альдегиды и кетоны реагируют с пентахлоридом фосфора в безводной среде, образуя дихлоралканы (последние, в свою очередь, широко используются в органическом синтезе).
СН3СНО + РСl5 → СН3СНСl2 + POCl
СН3-СО-СН3 + РСl5 → СН3-ССl2-СН3 + РОСl3
Фосфорные кислоты
Фосфорные кислоты. Под этим названием объединяют кислоты, содержащие атомы фосфора в степени окисления +5. Из трех фосфорных кислот наибольшее практическое значение имеет ортофосфорная кислота Н3РO4 (часто ее называют просто фос форной) — белое твердое вещество, хорошо растворимое в воде. В водном растворе она диссоциирует ступенчато. Будучи трехосновной, фосфорная кислота образует три типа солей: дигидрофосфаты (например, NaH2PO4); гидрофосфаты (Na2HPO4); фосфаты (Na3PO4). Все дигидрофосфаты растворимы в воде. Из гидрофосфатов и фосфатов в воде растворимы только соли щелочных металлов и аммония.
Соли фосфорной кислоты — ценные минеральные удобрения, самые распространенные среди них — суперфосфат, преципитат и фосфоритная мука. Простой суперфосфат — смесь дигидрофосфата кальция Са(Н2РO4)2 и «балласта» CaS04. Его получают, путем обработки серной кислотой фосфоритов и апатитов. При обработке минеральных фосфатов фосфорной кислотой получают двойной суперфосфат Са(Н2РO4)2. При гашении фосфорной кислоты известью получают преципитат СаНРO4 • 2Н2О.
Важное значение имеют сложные удобрения (т.е. содержащие одновременно азот и фосфор или азот, фосфор и калий), например аммофос — смесь NH4H2PO4 и (NH4)2HPO4.
Низшие кислородные кислоты фосфора. При взаимодействии Р4Об с водой образуется фосфористая кислота Н3РO3.
Несмотря на то что эта кислота содержит три атома водорода, она двухосновная, так как третий водород не «кислый», т. е. не отщепляется (не диссоциирует по кислотному типу) в водных растворах. Фосфористая кислота — кислота средней силы (Кх = 2 • 10-2; К2 = 2 • 107), образует два ряда солей — фосфиты и гидрофосфиты. Известна также одноосновная фосфорноватистая кислота Н3РO2 средней силы (К = 9 • 10-2), соли — гипофосфиты.
Оксиды углерода
Углерод образует два оксида — СО и СO2.
Оксид углерода (II) CO — это бесцветный, не имеющий запаха газ, малорастворимый в воде. Его называют угарным газом, т. к. он очень ядовит. Попадая при дыхании в кровь, быстро соединяется с гемоглобином, образуя прочное соединение карбок- сигемоглобин, лишая тем самым возможности гемоглобина переносить кислород. При вдыхании воздуха, содержащего 0,1 % СО, человек может внезапно потерять сознание и умереть. Угарный газ образуется при неполном сгорании топлива, вот почему так опасно преждевременное закрывание дымоходов. Оксид СО относят к несолеобразующим оксидам, т. к., будучи оксидом неметалла, он должен реагировать со щелочами и основными оксидами, однако этого не наблюдается. СО — хороший восстановитель. Он сгорает в кислороде, образуя углекислый газ:
Оксид углерода (II) способен отнимать кислород у оксидов металлов, т. е. восстанавливать металл из их оксидов:
Именно это свойство оксида углерода (II) используется в металлургии при выплавке чугуна.
Оксид углерода (IV) CO2, широко известный под названием углекислый газ, — бесцветный, не имеющий запаха газ. Он примерно в полтора раза тяжелее воздуха. При обычных условиях в одном объеме воды растворяется один объем углекислого газа. При давлении примерно 60 атм. углекислый газ превращается в бесцветную жидкость. При испарении жидкого углекислого газа часть его превращается в твердую снегообразную массу, которую в промышленности прессуют, — это известный сухой лед, который применяется для хранения пищевых продуктов. Твердый углекислый газ имеет молекулярную решетку и способен к возгонке.
СО2 — это типичный кислотный оксид: взаимодействует со щелочами (вызывает помутнение известковой воды), с основными оксидами и водой.
Он не горит и не поддерживает горения и поэтому применяется для тушения пожаров. Однако магний продолжает гореть в углекислом газе с образованием оксида и выделением углерода в виде сажи:
Углекислый газ получают, действуя на соли угольной кислоты — карбонаты — растворами соляной, азотной и даже уксусной кислот. В лаборатории углекислый газ получают при действии на мел или мрамор соляной кислотой:
В промышленности большие количества углекислого газа получают обжигом известняка:
Углекислый газ, кроме уже названной области применения, используют для приготовления шипучих напитков и для получения соды.
Угольная кислота и ее соли

При растворении оксида углерода (IV) в воде образуется угольная кислота Н2СО3, которая очень нестойкая и легко разлагается на исходные компоненты — углекислый газ и воду:
Равновесие этой реакции смещено влево.
Как двухатомная кислота она образует два ряда солей: средние — карбонаты и кислые — гидрокарбонаты. Из карбонатов в воде растворимы только соли калия, натрия и аммония. Кислые соли, как правило, растворимы в воде. При избытке углекислого газа в присутствии воды карбонаты могут превращаться в гидрокарбонаты. Так, если через известковую воду пропускать углекислый газ, то она сначала помутнеет из-за выпавшего в осадок нерастворимого в воде карбоната кальция, однако при дальнейшем пропускании углекислого газа помутнение исчезает в результате образования растворимого гидрокарбоната кальция:
Карбонаты и гидрокарбонаты можно обнаружить с помощью растворов кислот: при действии на них кислот наблюдается характерное «вскипание» из-за выделяющегося углекислого газа:
Эта реакция является качественной реакцией на соли угольной кислоты.
Соли угольной кислоты
Карбонаты только щелочных металлов и аммония растворимы в воде. Гидрокарбонаты большинства металлов хорошо растворимы в воде.
Са(ОН)2 + СО2 = СаСО3↓ + Н2О
Под действием избытка оксида углерода(IV) нерастворимые в воде карбонаты превращаются в растворимые гидрокарбонаты.
СаСО3 + Н2О + СО2 = Са(НСО3)2
Гидрокарбонаты при нагревании разлагаются на карбонаты, углекислый газ и воду.
2NaHCО3 = Na2CО3 + Н2О + СО2↑
Все карбонаты, кроме карбонатов щелочных металлов, при нагревании разлагаются на оксид металла и диоксид углерода.
MgCO3 = MgO + CO2↑
Из солей угольной кислоты наибольшее значение имеет карбонат натрия, или сода; известны различные кристаллогидраты соды: Na2CО3 • 10Н2О, Na2CО3-7H2O и Na2CО3-H2О, из них самый устойчивый Na2CO3 • 10Н2O, который обычно называют кристаллической содой. При ее прокаливании получают безводную, или кальцинированную, соду Na2CO3 .Широко используют также питьевую соду NaHCО3. Из других солей угольной кислоты важное значение имеют К2СО3 и СаСО3.
Основные количества соды получают по аммиачному способу; часто этот способ получения соды называют методом Сольве.
Суть этого метода заключается в насыщении концентрированного (точнее, насыщенного) раствора поваренной соли (NaCl) аммиаком при охлаждении и последующем пропускании через этот раствор СО2 под давлением. При этом идут следующие реакции:
NH3 + СO2 + H2O = NH4HCO3
NH4HCO3 + NaCl = NaHCO3↓ + NH4Cl
Питьевая сода NaHCО3 нерастворима в образующемся холодном насыщенном растворе, и ее отделяют фильтрованием. При прокаливании NaHCО3 получают кальцинированную соду (выделяющийся при этом СО2 возвращают в производственный процесс).
2NaHCO3 = Na2CO3 + СO2 + Н2O
Раствор, содержащий хлорид аммония, нагревают с известью, при этом выделяется аммиак.
2NH4Cl + Са(ОН)2 = 2NH3↑ + СаСl2 + 2Н2О
Таким образом, в аммиачном способе получения соды единственным «отходом» является хлорид кальция, остающийся в растворе и имеющий ограниченное применение.
Поташ К2СО3 нельзя получить по методу Сольве, в основе которого лежит малая растворимость кислой соли NaHCО3 в воде. Гидрокарбонат калия КНСО3 (в отличие от NaHCO3) хорошо растворим,
КСl + NH4HCO3 ⇆ КНСO3 + NH4Cl
и реакция полностью обратима (ни один из продуктов не удается удалить из сферы реакции). Поэтому карбонат калия получают действием СО2 на раствор едкого кали.
КОН + СО2 = КНСО3
КНСО3 + КОН = К2СО3 + Н2О
Производство соды — одно из самых крупнотоннажных производств среди технологических процессов получения неорганических веществ; в настоящее время мировое производство соды оценивают в десятки миллионов тонн.
Оксиды кремния
Оксид кремния(IV) и кремниевые кислоты. Оксид кремния(IV) SiO2 (или кремнезём) — твердое, очень тугоплавкое вещество (температура плавления более 1700 °С). SiO2 широко распространен в природе (речной и морской песок, песчанник), встречается в виде кварца, а также минералов кристобалита и тридимита.
При обычных температурах устойчивой модификацией является кварц; с ростом температуры происходят следующие превращения:
Кремнезём во всех модификациях не существует в виде мономера-, он всегда «построен» из тетраэдров [SiO4], образующих бесконечную (полимерную) очень прочную атомную решетку.
В кристаллах (SiO2)n атомы кремния тетраэдрически окружены четырьмя атомами кислорода, каждый из которых мостиковый. Через этот общий атом кислорода тетраэдры [SiO4] под разными углами связаны друг с другом, образуя непрерывную трехмерную решетку; взаимное расположение тетраэдров [SiO4] в пространстве определяет ту или иную модификацию кремнезёма.
В модификациях кремнезёма прочность связей различна. Это влияет на величину углов Si-O-Si и расстояний Si-O, например в различных модификациях кремнезёма валентный угол Si-O-Si изменяется от 120 до 180°.
Переходы кварц → тридимит → кристобалит сопровождаются разрывом и преобразованием связей, что может происходить только при высоких температурах.
Кварц нередко встречается в природе в форме очень хорошо образованных кристаллов, иногда значительной величины. Кристаллы состоят из тетраэдров, расположенных винтообразно в виде спирали вокруг центральной оси. В двух разных кристаллах направление спирали может быть противоположным. Такие кристаллы являются оптическими изомерами. Они по-разному вращают плоскость поляризации света, причем могут быть как право-, так и левовращающими. Структуры право- и левообращающих кристаллов относятся друг к другу, как предмет и его зеркальное изображение.
Кварц находит применение в науке и технике. Кристаллы кварца часто выращивают искусственно. Некоторые разновидности кварца носят особые названия. Прозрачные бесцветные кристаллы называют горным хрусталем. Встречаются и окрашенные разновидности кварца: розовый кварц, фиолетовый (аметист), темно-коричневый (дымчатый топаз), зеленый (хризопраз) и другие. Мелкокристаллическую модификацию кварца с примесями других веществ называют халцедоном. Разновидностями халцедона являются агат, яшма и другие. Горный хрусталь и окрашенные разновидности кварца используют как драгоценные и полудрагоценные камни.
Тридимит встречается в вулканических породах, однако в очень небольших количествах. Известен тридимит метеоритного происхождения.
Кристобалит в природе иногда встречается в виде мелких кристаллов, включенных в лаву, подобно тридимиту. Тридимит и кристобалит обладают более «рыхлой» структурой, нежели кварц. Так, плотность кристобалита, тридимита и кварца: 2,32; 2,26 и 2,65 г/см3 соответственно.
Расплав кремнезёма при медленном охлаждении легко образует аморфное кварцевое стекло. Кремнезём в виде стекла встречается и в природе. Плотность аморфного стекла 2,20 г/см3 — ниже, чем у всех кристаллических модификаций кварца. Кварцевое стекло имеет незначительный температурный коэффициент расширения, поэтому из него изготавливают специальную (кварцевую) лабораторную посуду, устойчивую к резким изменениям температуры.
Все модификации кремнезёма практически нерастворимы в воде (при температуре 25 °С растворимость кварца 7, кристобалита 12, тридимита 16, кварцевого стекла 83 мг/л). При обычных условиях на кремнезём действуют лишь растворы щелочей и плавиковая кислота.
SiО2 + 2КОН = K2SiО3 + Н2О
SiО2 + 4HF = SiF4 + 2Н2О
Реакция с плавиковой кислотой происходит при травлении стекла. При сплавлении диоксид кремния реагирует с основными оксидами, щелочами и карбонатами с образованием силикатов.
SiО2 + СаО = CaSiO3
SiО2 + Na2CО3 = Na2SiО3 + CО2
Эти реакции лежат в основе промышленных технологий стекловарения, а также производства цемента.
Так, состав обычного стекла (например, оконного или для изготовления посуды) выражается формулой Na2О • СаО • 6SiO2. Такое стекло получают сплавлением смеси соды, песка и известняка. Процесс проводят при температуре -1400 °С до полного удаления газов.
Na2CO3 + СаСO3 + 6SiO2 = Na2O • СаО • 6SiO2 + 2CO2↑
Для получения специальных сортов огнеупорного и «небьющего- ся» стекла при варке добавляют оксиды бария, свинца, бора. Для получения цветных стекол вносят также различные добавки: например, оксид кобальта(Ш) Со2O3 дает синий цвет, оксид хрома(Ш) Сr2O3 — зеленый, оксид марганца(IV) МnO2 — розовый.
Оксид SiO2 — ангидрид ряда кремниевых кислот, состав которых можно выразить общей формулой xSiO2 • yH2O, где х и у — целые числа:
- х = 1, у = 1: SiO2 • Н2O = H2SiO3 — метакремниевая кислота;
- х= 1, у = 2: SiO2 • 2Н2O = H4SiO4 — ортокремниевая кислота;
- х = 2, у = 1: 2SiO2 • Н2O = H2Si2O5 — двуметакремниевая кислота.
Кислоты, молекулы которых содержат более одной молекулы SiO2, относятся к поликремниевым.
Самая простая из кремниевых кислот — H2SiO3, которую часто называют просто кремниевой, а ее соли — силикатами. Из силикатов в воде растворимы только силикаты натрия и калия, остальные силикаты — тугоплавкие, нерастворимые в воде вещества.
Растворы силикатов при стоянии на воздухе мутнеют, так как находящийся в воздухе СO2 вытесняет кремниевую кислоту из ее солей (H2SiO3 слабее угольной кислоты; константа диссоциации H2SiO3 по первой ступени К1 = 2,2 • 10—10).
Кремниевая кислота H2SiO3 практически нерастворима в воде; это свойство используют как качественную реакцию для обнаружения силикат-ионов.
Na2SiO3 + СO2 + Н2O = Na2CO3 + H2SiO3↓
Получают силикаты сплавлением SiO2 со щелочами или карбонатами (см. выше).
Концентрированные растворы силикатов натрия и калия называют жидким стеклом, они имеют сильнощелочную реакцию, поскольку сильно гидролизованы.
K2SiO3 + Н2О ⇆ 2КОН + H2SiО3↓,
Жидкое стекло используют, например, для изготовления клея, водонепроницаемых тканей.
Цемент очень широко используют в строительстве как вяжущий материал; при смешивании с водой цемент затвердевает. Обычно цемент получают в больших вращающихся печах, где происходит обжиг и размол различных силикатов (при температуре -1000 °С).
Промышленность производит цементы различных марок. Однако по принципу «схватывания» условно можно выделить два типа цементов: обычный цемент и портландцемент. Процесс «схватывания» обычного цемента, состоящего из силиката кальция, происходит вследствие образования карбоната кальция при взаимодействии с углекислым газом воздуха.
СаО • SiО2 + СО2 + Н2О = CaCО3↓ + H2SiО3↓
При схватывании портландцемента углекислота не участвует в процессе, а происходит гидролиз силикатов с последующим образованием нерастворимых кристаллогидратов.
Ca3SiO5 + Н2О — Ca2SiО4 + Са(ОН)2
Ca2SiО4 + 4Н2О = Ca2SiО4 • 4Н2О↓
Карбиды и силициды
Силициды получают также взаимодействием кремния с гидридами металлов, например:
2СаН2 + Si = Ca2Si + 2H2↑
Все эти реакции протекают при высоких температурах. Среди карбидов выделяют так называемые метаниды и ацетилениды. Первые рассматривают как производные метана, содержащие углерод в степени окисления -4 (Ве2С, Аl4С3), вторые — как производные ацетилена, где степень окисления углерода -1 (Li2C2, Ag2C2, Cu2C2, СаС2). Ацетилениды серебра и меди(1) могут быть легко получены при пропускании ацетилена через аммиачный раствор оксида серебра или хлорида меди(1). Большинство метанидов и ацетиленидов активно реагируют с водой (тем более с кислотами), выделяя соответствующие углеводороды.
СаС2 + 2Н2О = Са(ОН)2 + С2Н2
Аl4С3 + 12Н2О = 4Аl(ОН)3↓ + ЗСН4
Ag2C2 + 2НСl = 2AgCl↓ + С2Н2
В отличие от карбидов, с водой и кислотами взаимодействуют лишь силициды щелочных или щелочноземельных металлов, выделяя водородное соединение кремния моносилан SiH4, которое чаще всего называют просто силан.
Ca2Si + 4НСl = 2СаСl2 + SiH4↓
Силан — бесцветный газ, имеющий запах плесени, самопроизвольно воспламеняющийся на воздухе, сгорая до SiO2 и воды.
SiH4 + 2О2 = SiО2 + 2Н2О
Щелочи очень легко реагируют с силаном.
SiH4 + 2КОН + Н2О = K2SiО3 + 4H2↑
Вода также гидролизует силан, но значительно медленнее.
SiH4 + 2H2О = SiО2 + 4H2↑
При нагревании выше 400 °С без доступа воздуха силан распадается на кремний и водород (один из способов получения чистого кремния).
SiH4 = Si + 2H2↑
Кроме моносилана SiH4 известны также дисилан Si2H6, три силан Si3H8, тетрасилан Si4H10 и т. д. В индивидуальном состоянии в ряду силанов выделены соединения лишь до Si6H14 включительно. Гомологическому ряду силанов отвечает общая формула SinH2n+2.Подобно алканам, силаны бесцветны, первые члены гомологического ряда при обычных условиях газы, следующие — жидкости. Химическая активность силанов и углеводородов (алканов) различна: в противоположность достаточно инертным алканам силаны весьма реакционноспособны. Это объясняется меньшим по сравнению с углеродом сродством кремния к водороду и очень большим сродством кремния к кислороду. К тому же связи Si-Si менее прочные, чем связи С-С. В отличие от связи С-Н связь Si-H имеет более ионный характер. В таблице приведены соответствующие энергии связей. Малой прочностью связи Si-Si обусловлена ограниченность гомологического ряда силанов.
Среди карбидов и силицидов особое место занимает карборунд SiC, который можно назвать как карбидом кремния, так и силицидом углерода. Благодаря алмазоподобной структуре карборунд имеет высокую температуру плавления; его твердость близка к твердости алмаза. Химически SiC очень стоек.
Открыть краткий конспект по теме
Справочный материал для прохождения тестирования:


















































![clip_image043_thumb[1] clip_image043_thumb[1]](/wp-content/uploads/2017/03/clip_image043_thumb1_thumb.png)
![clip_image044_thumb[1] clip_image044_thumb[1]](/wp-content/uploads/2017/03/clip_image044_thumb1_thumb.png)







![clip_image063_thumb[1] clip_image063_thumb[1]](/wp-content/uploads/2017/03/clip_image063_thumb1_thumb.png)

![clip_image065_thumb[1] clip_image065_thumb[1]](/wp-content/uploads/2017/03/clip_image065_thumb1_thumb.png)
![clip_image067_thumb[1] clip_image067_thumb[1]](/wp-content/uploads/2017/03/clip_image067_thumb1_thumb.png)













У неметаллов оказывается тоже много различных свойств, большое спасибо за информацию.
Признаться, не знал раньше, что при вдыхании воздуха с таким маленьким содержанием угарного газа можно умереть. Думал, что такими историями детей пугают. Так же раньше как то не задумывался как делают цемент. Расширил свой кругозор.
Вспомнил молодые годы, когда кочевал из аудитории Аналитической химии в аудиторию Органической химии, а потом на Физику химических процессов… Толково и понятно изложено, сжато но информативно.