Классификация органических и неорганических веществ
Оглавление
- Классификация веществ
- Классификация неорганических веществ
- Классификация органических веществ
- Циклические углеводороды
- Ациклические углеводороды
- Замещенные углеводороды
- Номенклатура
- Виды формул в органической химии
- Задания для самопроверки
Классификация веществ
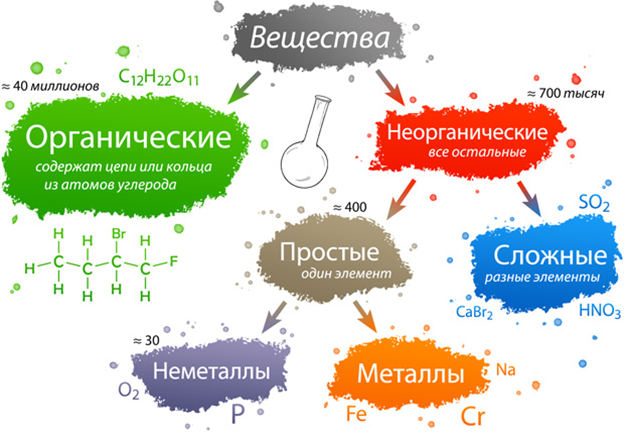
Самая простая классификация заключается в том. что все известные вещества делят на неорганические и органические. К органическим веществам относят углеводороды и их производные. Все остальные вещества — неорганические.
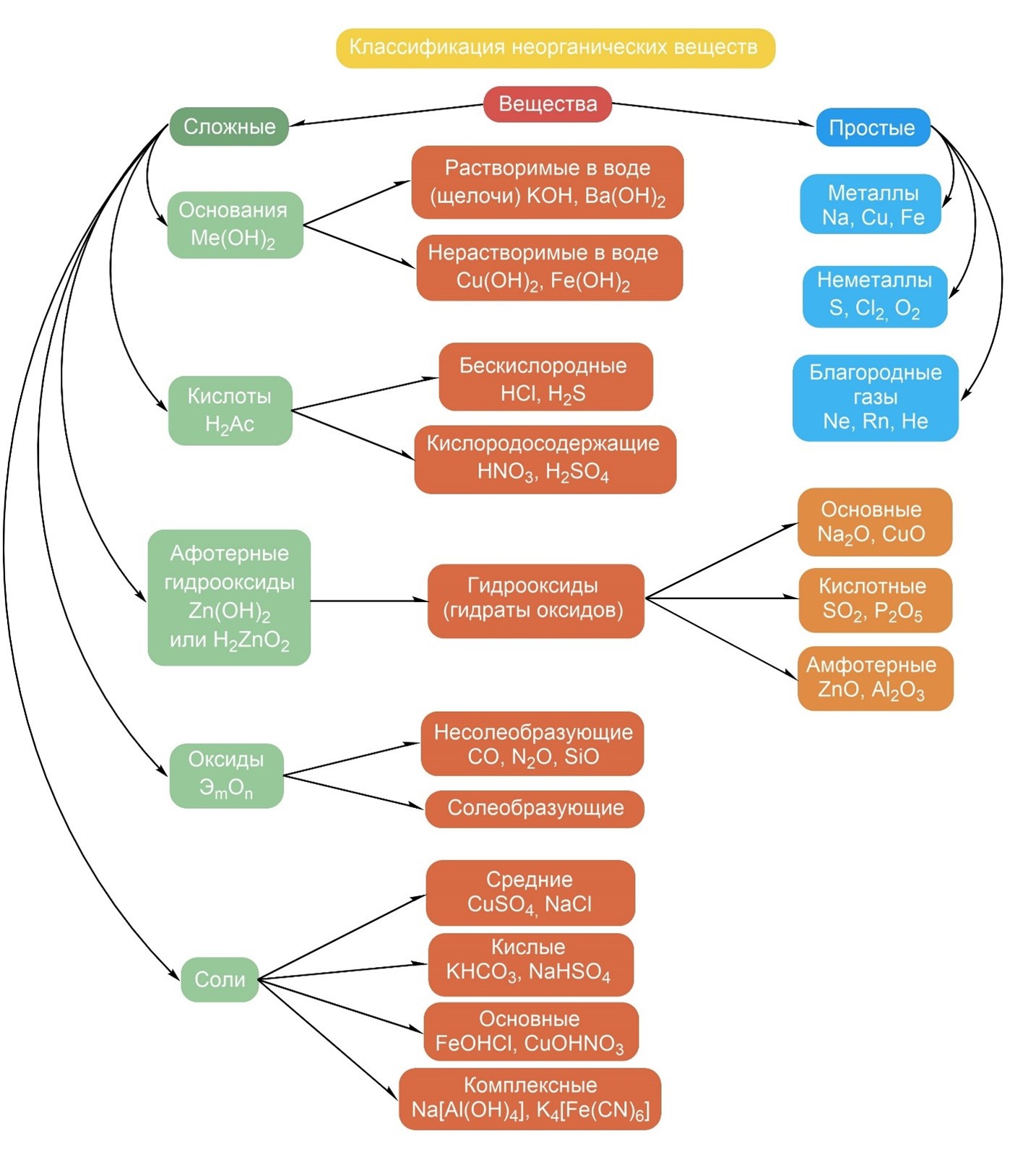
Классификация неорганических веществ
Неорганические вещества по составу делят на простые и сложные.
Простые вещества состоят из атомов одного химического элемента и подразделяются на металлы, неметаллы, благородные газы. Сложные вещества состоят из атомов разных элементов, химически связанных друг с другом.
Сложные неорганические вещества по составу и свойствам распределяют по следующим важнейшим классам: оксиды, основания, кислоты, амфотерные гидроксиды, соли.
- Оксиды — это сложные вещества, состоящие из двух химических элементов, один из которых — кислород со степенью окисления (—2). Общая формула оксидов: ЭmОn, где m — число атомов элемента Э, а n — число атомов кислорода. Оксиды, в свою очередь, классифицируют на солеобразующие и несолеобрадующие. Солеобразующие делятся на основные, амфотерные, кислотные, которым соответствуют основания, амфотерные гидроксиды, кислоты соответственно.
- Основные оксиды — это оксиды металлов в степенях окисления +1 и +2. К ним относятся:
- оксиды металлов главной подгруппы первой группы (щелочные металлы) Li — Fr
- оксиды металлов главной подгруппы второй группы (Mg и щелочноземельные металлы) Mg — Ra
- оксиды переходных металлов в низших степенях окисления
- Кислотные оксиды —образуют неметаллы со С.О. более +2 и металлы со С.О. от +5 до +7 (SO2, SeO2, Р2O5, As2O3, СO2, SiO2, CrO3 и Mn2O7). Исключение: у оксидов NO2 и ClO2 нет соответствующих кислотных гидроксидов, но их считают кислотными.
- Амфотерные оксиды — образованы амфотерными металлами со С.О. +2, +3,+4 (BeO, Cr2O3, ZnO, Al2O3, GeO2, SnO2 и РЬО).
- Несолеобразующие оксиды — оксиды неметаллов со С.О.+1, +2 (СО, NO, N2O, SiO).
- Основания — это сложные вещества, состоящие из атомов металла и одной или нескольких гидроксогрупп (-ОН). Общая формула оснований: М(ОН)у, где у — число гидроксогрупп, равное степени окислении металла М (как правило, +1 и +2). Основания делятся на растворимые (щелочи) и нерастворимые.
- Кислоты — (кислотные гидроксиды) — это сложные вещества, состоящие из атомов водорода, способных замещаться на атомы металла, и кислотных остатков. Общая формула кислот: НхАс, где Ас — кислотный остаток (от английского «acid» — кислота), х — число атомов водорода, равное заряду иона кислотного остатка.
- Амфотерные гидроксиды — это сложные вещества, которые проявляют и свойства кислот, и свойства оснований. Поэтому формулы амфотерных гидроксидов можно записывать и в форме кислот, и в форме оснований.
- Соли — это сложные вещества, состоящие из катионов металла и анионов кислотных остатков. Такое определение относится к средним солям.
- Средние соли — это продукты полного замещения атомов водорода в молекуле кислоты атомами металла или полного замещения гидроксогрупп в молекуле основания кислотными остатками.
- Кислые соли — атомы водорода в кислоте замещены атомами металла частично. Они получаются при нейтрализации основания избытком кислоты. Чтобы правильно назвать кислую соль, необходимо к названию нормальной соли прибавить приставку гидро- или дигидро- в зависимости от числа атомов водорода, входящих в состав кислой соли.Например, KHCO3 – гидрокарбонат калия, КH2PO4 – дигидроортофосфат калия. Нужно помнить, что кислые соли могут образовывать только двух и более основные кислоты.
- Осно́вные соли — гидроксогруппы основания (OH−) частично замещены кислотными остатками. Чтобы назвать основную соль, необходимо к названию нормальной соли прибавить приставку гидроксо- или дигидроксо- в зависимости от числа ОН – групп, входящих в состав соли.Например, (CuOH)2CO3 – гидроксокарбонат меди (II).Нужно помнить, что основные соли способны образовывать лишь основания, содержащие в своём составе две и более гидроксогрупп.
- Двойные соли — в их составе присутствует два различных катиона, получаются кристаллизацией из смешанного раствора солей с разными катионами, но одинаковыми анионами. Например, KAl(SO4)2, KNaSO4.
- Смешанные соли — в их составе присутствует два различных аниона. Например, Ca(OCl)Cl.
- Гидратные соли (кристаллогидраты) — в их состав входят молекулы кристаллизационной воды. Пример: Na2SO4 ·10H2O.
Классификация органических веществ
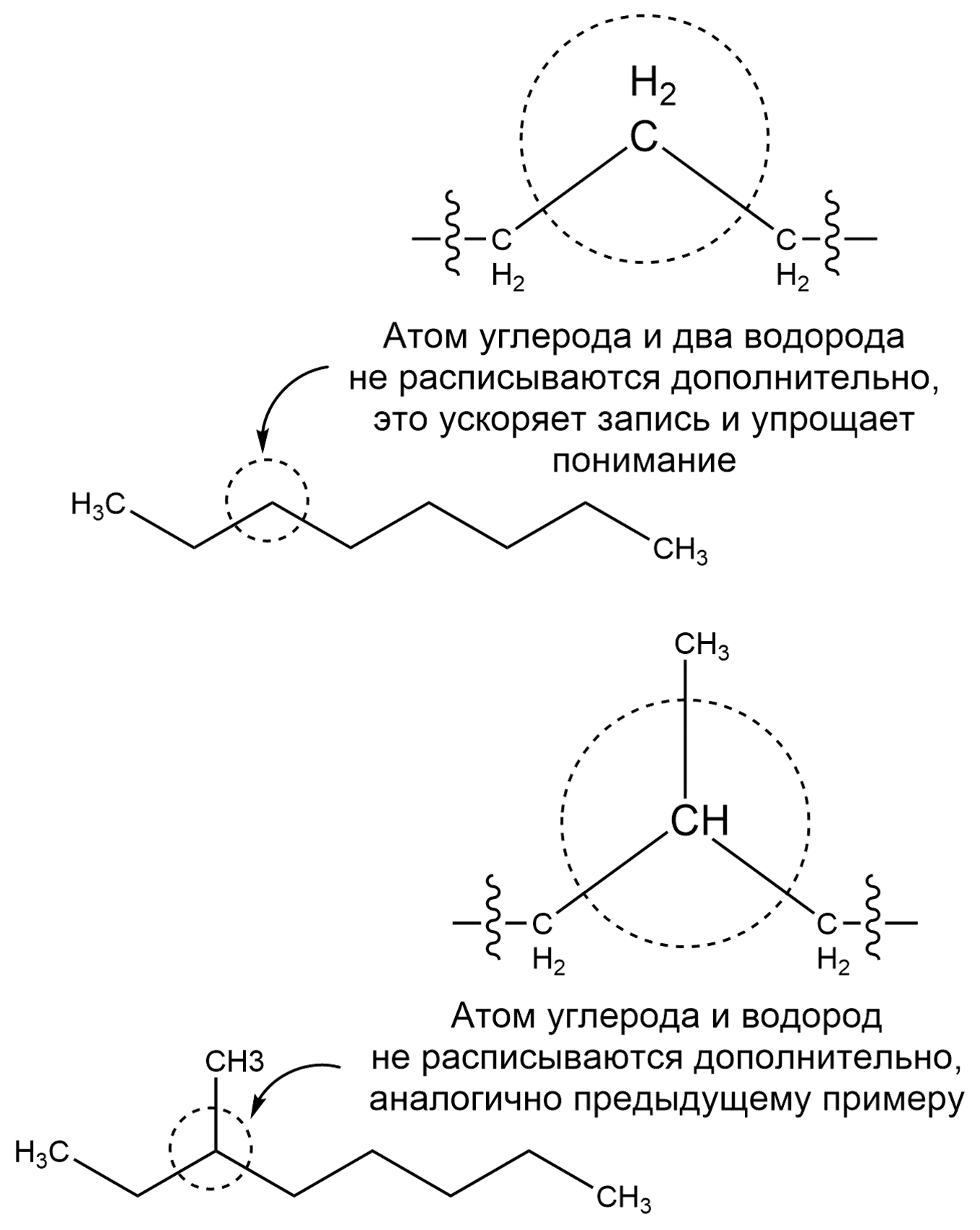
Соединения, состоящие только из атомов водорода и углерода, называют углеводородами. Прежде чем начать данный раздел, запомни, для упрощения записи, химики не расписывают в цепочках углероды и водороды, однако не забывай что углерод образует четыре связи, и если на рисунке углерод связан двумя связями, то еще двумя он связан с водородами, хоть последнее и не указано:
Циклические углеводороды
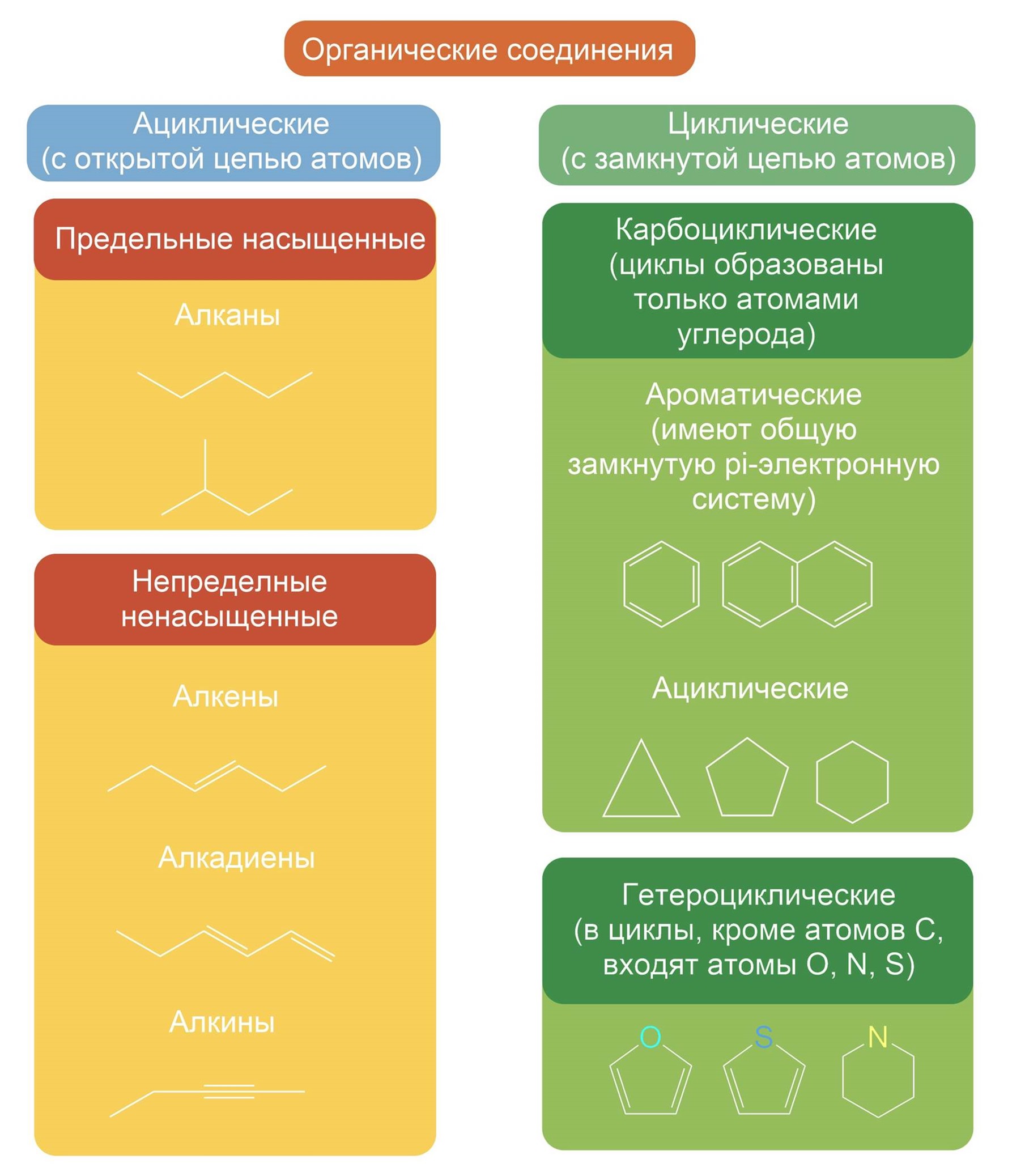
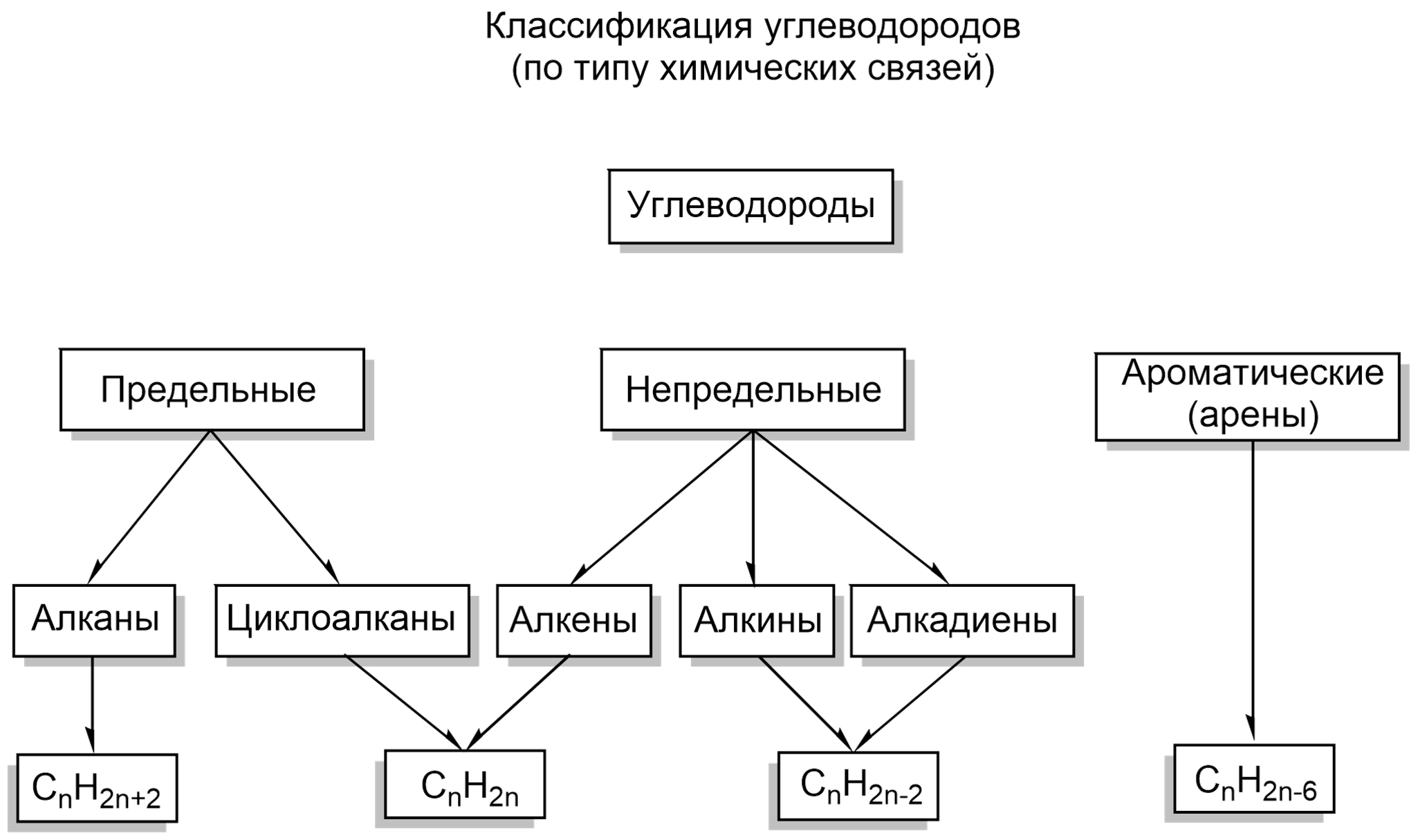
В зависимости от строения углеродной цепи органические соединения разделяют на соединения с открытой цепью — ациклические (алифатические) и циклические — с замкнутой цепью атомов.
Циклические делятся на две группы: карбоциклические соединения и гетероциклические.
Карбоциклическне соединения, в свою очередь, включают два ряда соединений: алициклические и ароматические.
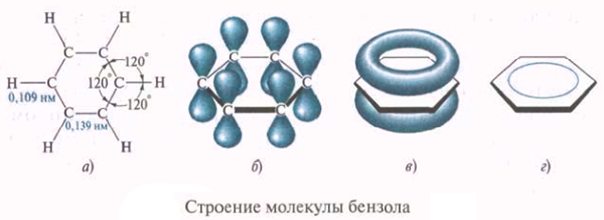
Ароматические соединения в основе строения молекул имеют плоские углеродсодержащие циклы с особой замкнутой системой π-электронов. образующих общую π-систему (единое π-электронное облако).
Как ациклические (алифатические), так и циклические углеводороды могут содержать кратные (двойные или тройные) связи. Такие углеводороды называют непредельными (ненасыщенными), в отличие от предельных (насыщенных), содержащих только одинарные связи.
Пи-связь (π-связь) — ковалентная связь, образующаяся перекрыванием p-атомных орбиталей. В отличие от сигма-связи, осуществляемой перекрыванием s-атомных орбиталей вдоль линии соединения атомов, пи-связи возникают при перекрывании p-атомных орбиталей по обе стороны от линии соединения атомов.
В случае образования ароматической системы, например, бензола C6H6, каждый из шести атомов углерода находится в состоянии sp2 — гибридизации и образует три сигма-связи с валентными углами 120 °. Четвёртый p-электрон каждого атома углерода ориентируется перпендикулярно к плоскости бензольного кольца. В целом возникает единая связь, распространяющаяся на все атомы углерода бензольного кольца. Образуются две области пи-связей большой электронной плотности по обе стороны от плоскости сигма-связей. При такой связи все атомы углерода в молекуле бензола становятся равноценными и, следовательно, подобная система более устойчива, чем система с тремя локализованными двойными связями.
Ациклические углеводороды
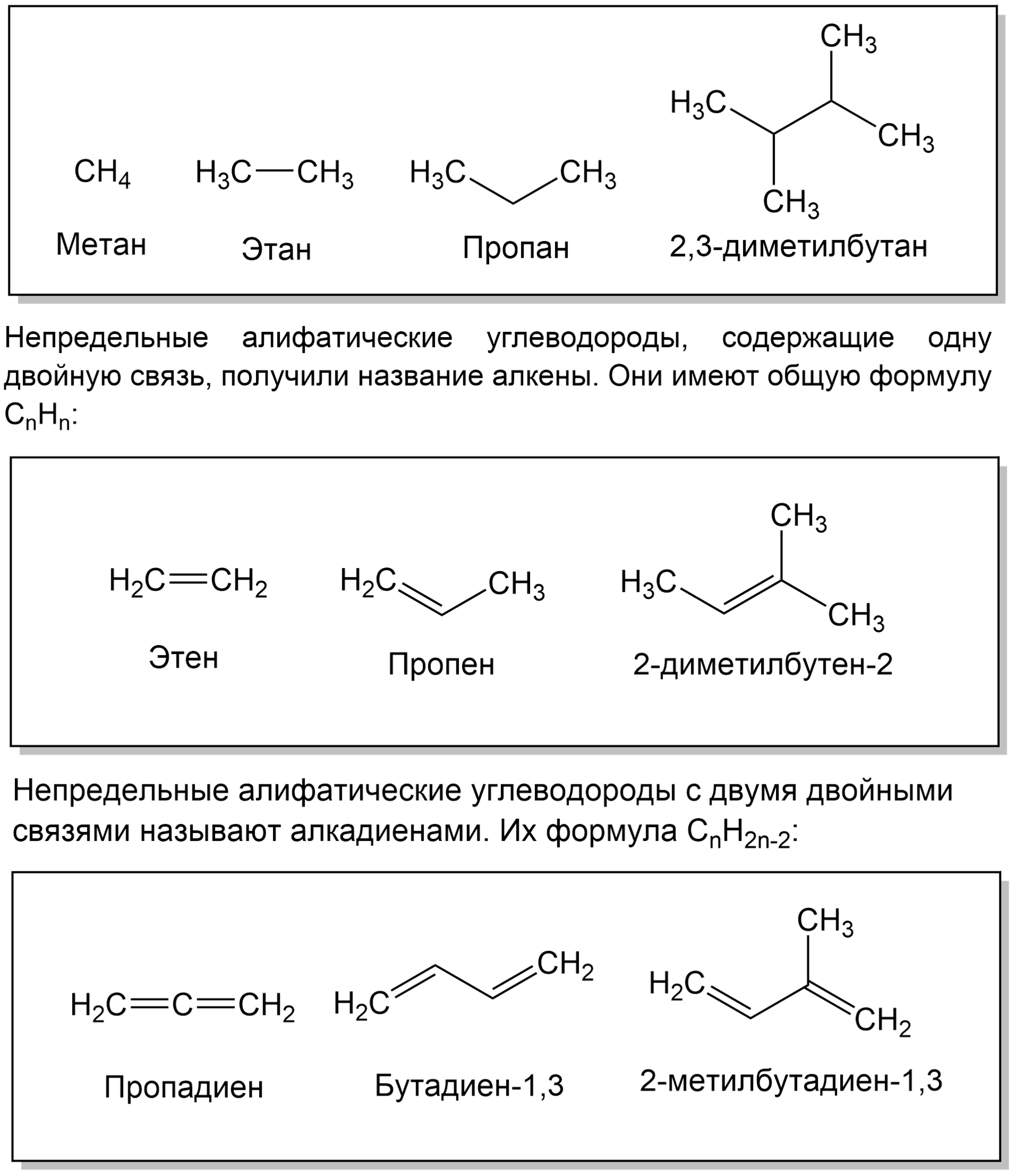
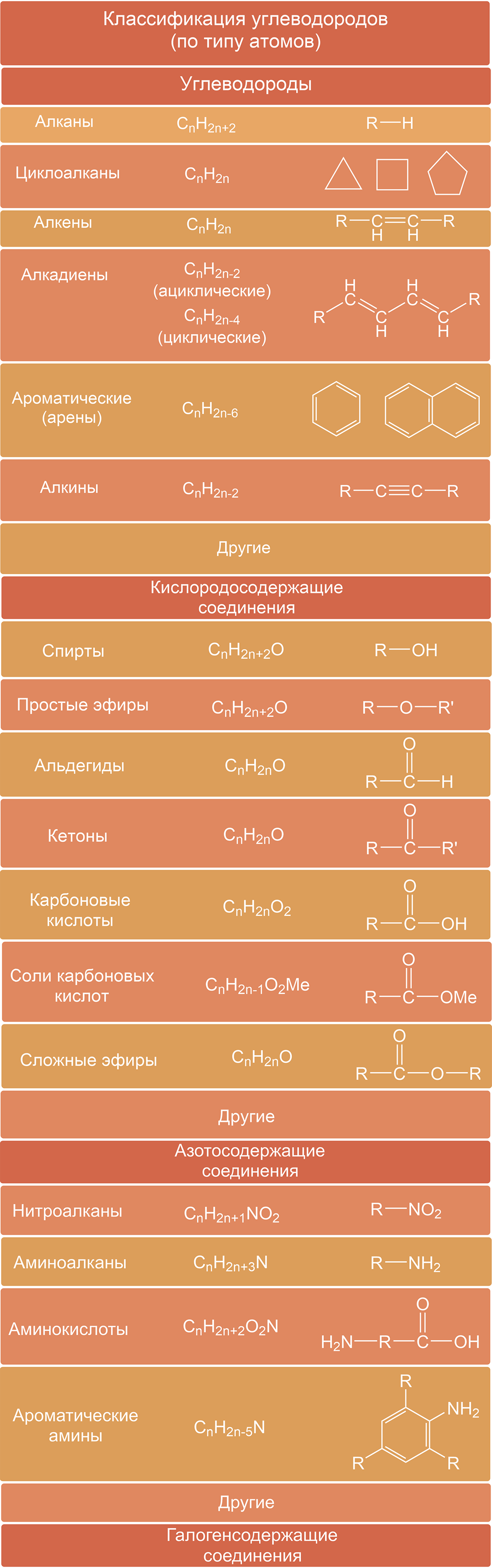
Предельные алифатические углеводороды называют алканами, они имеют общую формулу СnН2n + 2, где n — число атомов углерода. Старое их название часто употребляется и в настоящее время — парафины:
Непредельные алифатические углеводороды с одной тройной связью называют алкинами. Их общая формула СnН2n — 2
Предельные алициклические углеводороды — циклоалканы, их общая формула СnН2n:
Мы рассмотрели классификацию углеводородов. Но если в этих молекулах один или большее число атомов водорода заменить на другие атомы или группы атомов (галогены, гидроксильные группы, аминогруппы и др.), образуются производные углеводородов: галогенопроизводные, кислородсодержащие, азотсодержащие и другие органические соединения.
Атомы или группы атомов, которые определяют самые характерные свойства данного класса веществ, называются функциональными группами.
Углеводороды в их производные с одной и той же функциональной группой образуют гомологические ряды.
Гомологическим рядом называют ряд соединений, принадлежащих к одному классу (гомологов), по отличающихся друг от друга по составу на целое число групп —СН2— (гомологическую разность), имеющих сходное строение и, следовательно, сходные химические свойства.
Сходство химических свойств гомологов значительно упрощает изучение органических соединений.
Замещенные углеводороды
- Галогенопроизводные углеводородов можно рассматривать как продукты замещения в углеводородах одного или нескольких атомов водорода атомами галогенов. В соответствии с этим могут существовать предельные и непредельные моно-, ли-, три- (в общем случае поли-) галогенопроизводные.Общая формула галогенопроизводных предельных углеводородов R—Г.К кислородсодержащим органическим веществам относят спирты, фенолы, альдегиды, кетоны, карбоновые кислоты, простые и сложные эфиры.
- Спирты — производные углеводородов, в которых один или несколько атомов водорода замещены на гидроксильные группы.Спирты называют одноатомными, если они имеют одну гидроксильную группу, и предельными, если они — производные алканов.Общая формула предельных одноатомных спиртов: R—ОН.
- Фенолы — производные ароматических углеводородов (ряда бензола), в котором один или несколько атомов водорода в бензольном кольце замещены на гидроксильные группы.
- Альдегиды и кетоны — производные углеводородов, содержащие карбонильную группу атомов (карбонил).В молекулах альдегидов одна связь карбонила идет на соединение с атомом водорода, другая — с углеводородным радикалом.В случае кетонов карбонильная группа связана с двумя (в общем случае разными) радикалами.
- Простые эфиры представляют собой органические вещества, содержащие два углеводородных радикала, соединенные атомом кислорода: R=О—R или R—О—R2.Радикалы могут быть одинаковыми или разными. Состав простых эфиров выражается формулой СnН2n+2O.
- Сложные эфиры — соединения, образованные замещением атома водорода карбоксильной группы в карбоновых кислотах на углеводородный радикал.
- Нитросоединения — производные углеводородов, в которых один или несколько атомов водорода замещены на нитрогруппу —NO2.
- Амины — соединения, которые рассматривают как производные аммиака, в котором атомы водорода замещены на углеводородные радикалы.В зависимости от природы радикала амины могут быть алифатическими. В зависимости от числа замещенных на радикалы атомов водорода различают первичные амины, вторичные, третичные. В частном случае у вторичных, а также третичных аминов радикалы могут быть и одинаковыми. Первичные амины можно также рассматривать как производные углеводородов (алканов), в которых один атом водорода замещен на аминогруппу. Аминокислоты содержат две функциональные группы, соединенные с углеводородным радикалом, — аминогруппу —NH2 и карбоксил -СOОН.
Известны и другие важные органические соединения, которые имеют несколько разных или одинаковых функциональных групп, длинные линейные цепи, связанные с бензольными кольцами. В таких случаях строгое определение принадлежности вещества к какому-то определенному классу невозможно. Эти соединения часто выделяют в специфические группы веществ: углеводы, белки, нуклеиновые кислоты, антибиотики, алкалоиды и др. В настоящее время известно также много соединений, которые можно отнести и к органическим, и к неорганическим. Их называют элементоорганическими соединениями. Некоторые из них можно рассматривать как производные углеводородов.
Номенклатура
Рекомендуем посмотреть наш гайд по названию органических веществ!
Для названия органических соединений используют 2 номенклатуры – рациональную и систематическую (ИЮПАК) и тривиальные названия.
Составление названий по номенклатуре ИЮПАК:
1) Основу названия соединения составляет корень слова, обозначающий предельный углеводород с тем же числом атомов, что и главная цепь.
2) К корню добавляют суффикс, характеризующий степень насыщенности:
-ан (предельный, нет кратных связей);
-ен (при наличии двойной связи);
-ин (при наличии тройной связи).

Если кратных связей несколько, то в суффиксе указывается число таких связей (-диен, -триен и т.д.), а после суффикса обязательно указывается цифрами положение кратной связи, например:
СН3–СН2–СН=СН2 СН3–СН=СН–СН3
бутен-1 бутен-2
СН2=СН–СН=СН2
бутадиен-1,3
3) Далее в суффикс выносится название самой старшей характеристической группы в молекуле с указанием ее положения цифрой.
Такие группы как нитро-, галогены, углеводородные радикалы, не входящие в главную цепь выносятся в приставку. При этом они перечисляются по алфавиту. Положение заместителя указывается цифрой перед приставкой.
Порядок составления названия следующий:
1. Найти самую длинную цепь атомов С.
2. Последовательно пронумеровать атомы углерода главной цепи, начиная с ближайшего к разветвлению конца.
3. Название алкана складывается из названий боковых радикалов, перечисленных в алфавитном порядке с указанием положения в главной цепи, и названия главной цепи.
Виды формул в органической химии
Химический язык, в состав которого в качестве одной из наиболее специфических частей входит химическая символика (включающая и химические формулы), является важным активным средством познания химии и требует поэтому четкого и осознанного применения.
Химические формулы — это условные изображения состава и строения химически индивидуальных веществ посредством химических символов, индексов и других знаков. При изучении состава, химического, электронного и пространственного строения веществ, их физических и химических свойств, изомерии и других явлений применяют химические формулы разных видов.
Особенно много видов формул (простейшие, молекулярные, структурные, проекционные, конформационные и др.) применяют при изучении веществ молекулярного строения — большинства органических веществ и сравнительно небольшой части неорганических веществ при обычных условиях. Значительно меньше видов формул (простейшие) применяют при изучении немолекулярных соединений, строение которых более наглядно отражают шаростержневые модели и схемы кристаллических структур или их элементарных ячеек.

Составление полных и кратких структурных формул углеводородов
Пример:
Составить полную и краткую структурные формулы пропана С3Н8.
Решение:
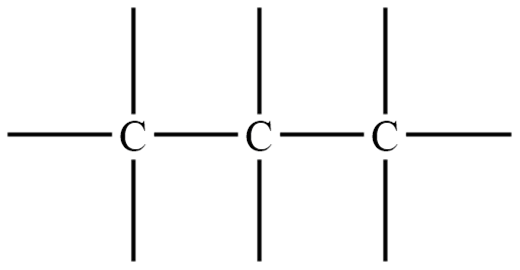
1. Записать в строчку 3 атома углерода, соединить их связями:
С–С–С
2. Добавить черточки (связи) так, чтобы от каждого атома углерода отходило 4 связи:
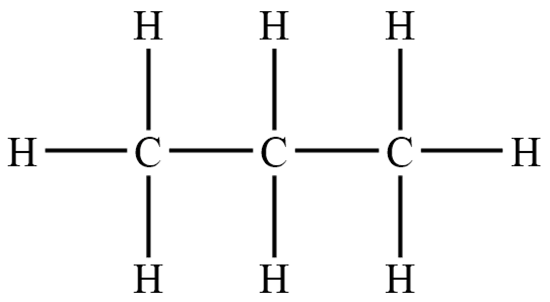
3. Напротив каждой свободной связи расставить атомы водорода:
4. Записать краткую структурную формулу:
СН3–СН2–СН3
Справочный материал для прохождения тестирования:




































Интересно было почитать, закрепила материал. В учебнике тоже читала, но здесь даже понятнее.
Я бы назвала тему «просто об очень сложном») Темы по неорганике мне давались и даются легко, а вот органика очень тяжела для меня. Некоторая информация для меня оказалась новой, остальное помогло освежить знания.
Ошибка там, в самом начале, оксиды-это соединения состоящие из двух элементов один из которых кислород со степенью окисления «-2»