Соли
Оглавление
- Номенклатура солей
- Растворимость солей
- Классификация солей
- Свойства солей
- Способы получения солей
- Шпаргалки
- Задания для самопроверки
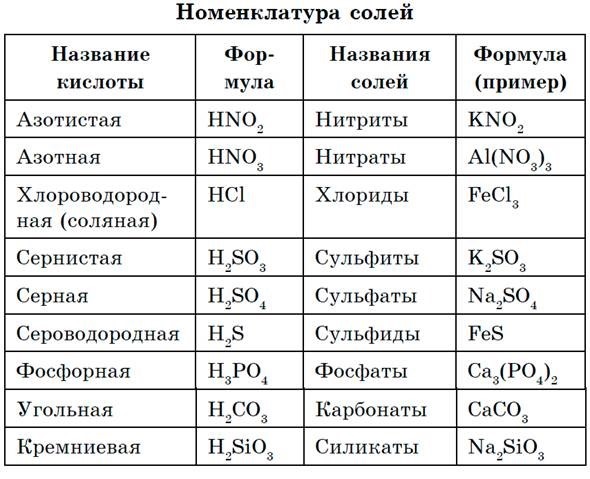
Номенклатура солей
Определение солей в рамках теории диссоциации. Соли принято делить на три группы: средние, кислые и основные. В средних солях все атомы водорода соответствующей кислоты замещены на атомы металла, в кислых солях они замещены только частично, в основных солях группы ОН соответствующего основания частично замещены на кислотные остатки.
Существуют также некоторые другие типы солей, например двойные соли, в которых содержатся два разных катиона и один анион: СаСО3 • MgCO3 (доломит), КСl • NaCl (сильвинит), KAl(SO4)2 (алюмокалиевые квасцы); смешанные соли, в которых содержится один катион и два разных аниона: СаОСl2 (или Са(ОСl)Сl); комплексные соли, в состав которых входит комплексный ион, состоящий из центрального атома, связанного с несколькими лигандами: K4[Fe(CN)6] (желтая кровяная соль), K3[Fe(CN)6] (красная кровяная соль), Na[Al(OH)4], [Ag(NH3)2]Cl; гидратные соли (кристаллогидраты), в которых содержатся молекулы кристаллизационной воды: CuSO4 • 5H2O(медный купорос), Na2SO4 • 10Н2О (глауберова соль).
Название солей образуют из названия аниона, за которым следует название катиона.
Для солей бескислородных кислот к названию неметалла добавляют суффикс ид, например хлорид натрия NaCl, сульфид железа(Н) FeS и др.
При наименовании солей кислородсодержащих кислот к латинскому корню названия элемента добавляют в случае высших степеней окисления окончание —am, в случае низших степеней окисления окончание -ит. В названиях некоторых кислот для обозначения низших степеней окисления неметалла используют приставку гипо-, для солей хлорной и марганцовой кислот используют приставку пер-, например: карбонат кальция СаСО3, сульфат железа(III) Fe2(SO4)3, сульфит железа(II) FeSO3, гипохлорит калия КОСl, хлорит калия КОСl2, хлорат калия КОСl3, перхлорат калия КОСl4, перманганат калия КМnO4, дихромат калия К2Сг2O7.
Кислые и основные соли можно рассматривать как продукт неполного превращения кислот и оснований. По международной номенклатуре атом водорода, входящий в состав кислой соли, обозначают приставкой гидро-, группу ОН — приставкой гидрокси, NaHS — гидросульфид натрия, NaHSO3 — гидросульфит натрия, Mg(OH)Cl — гидроксихлорид магния, Аl(ОН)2Сl — дигидроксихлорид алюминия.
В названиях комплексных ионов сначала указывают лиганды, завершают названием металла с указанием соответствующей степени окисления (римскими цифрами в скобках). В названиях комплексных катионов используют русские названия металлов, например: [Cu(NH3)4]Cl2 — хлорид тетраамминмеди(П), [Ag(NH3)2]2SO4 — сульфат диамминсеребра(1). В названиях комплексных анионов используют латинские названия металлов с суффиксом -ат, например: К[Аl(ОН)4] — тетрагидроксиалюминат калия, Na[Cr(OH)4] — тетра- гидроксихромат натрия, K4[Fe(CN)6] — гексацианоферрат(Н) калия.
Названия гидратных солеи (кристаллогридратов) образуются двумя способами. Можно воспользоваться системой названий комплексных катионов, описанной выше; например, медный купорос [Cu(H2O)4]SO4 • Н20 (или CuSO4 • 5Н2O) можно назвать сульфат тетрааквамеди(П). Однако для наиболее известных гидратных солей чаще всего число молекул воды (степень гидратации) указывают численной приставкой к слову «гидрат», например: CuSO4 • 5Н2O — пентагидрат сульфата меди(И), Na2SO4 • 10Н2О — декагидрат сульфата натрия, СаСl2 • 2Н2O — дигидрат хлорида кальция.
Растворимость солей
По растворимости в воде соли делятся на растворимые (Р), нерастворимые (Н) и малорастворимые (М). Для определения растворимости солей пользуются таблицей растворимости кислот, оснований и солей в воде. Если таблицы под рукой нет, то можно воспользоваться правилами. Их легко запомнить.
1. Растворимы все соли азотной кислоты — нитраты.
2. Растворимы все соли соляной кислоты — хлориды, кроме AgCl(Н), PbCl2(М).
3. Растворимы все соли серной кислоты — сульфаты, кроме BaSO4(Н), PbSO4(Н).
4. Растворимы соли натрия и калия.
5. Не растворяются все фосфаты, карбонаты, силикаты и сульфиды, кроме солей Na+ и K+.
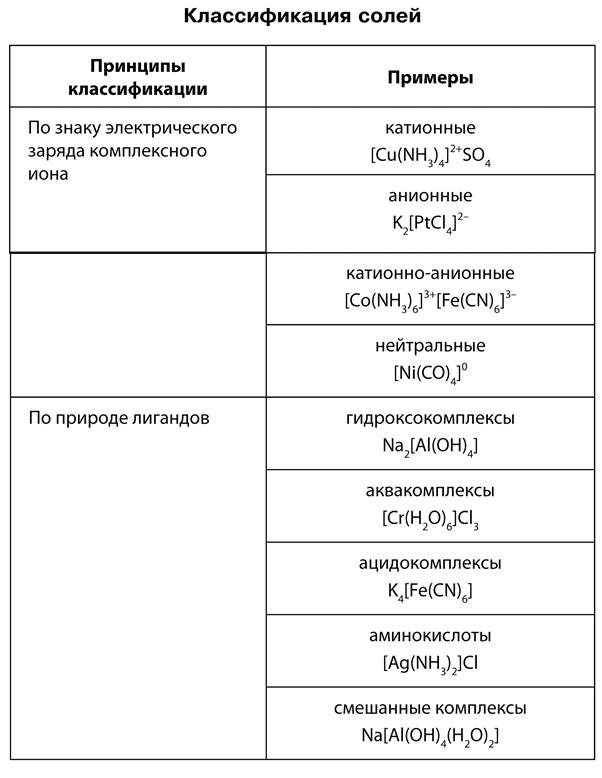
Классификация солей
Из всех химических соединений соли являются наиболее многочисленным классом веществ. Это твердые вещества, они отличаются друг от друга по цвету и растворимости в воде. В начале XIX в. шведский химик И. Берцелиус сформулировал определение солей как продуктов реакций кислот с основаниями или соединений, полученных заменой атомов водорода в кислоте металлом. По этому признаку различают соли средние, кислые и основные. Средние, или нормальные, соли — это продукты полного замещения атомов водорода в кислоте на металл.
Например:
Na2CO3 — карбонат натрия;
CuSO4 — сульфат меди (II) и т. д.
Диссоциируют такие соли на катионы металла и анионы кислотного остатка:
Na2CO3 = 2Na+ + CO2—
Кислые соли — это продукты неполного замещения атомов водорода в кислоте на металл. К кислым солям относят, например, питьевую соду NaHCO3, которая состоит из катиона металла Na+ и кислотного однозарядного остатка HCO3—. Для кислой кальциевой соли формула записывается так: Ca(HCO3)2. Названия этих солей складываются из названий средних солей с прибавлением приставки гидро-, например:
Mg(HSO4)2 — гидросульфат магния.
Диссоциируют кислые соли следующим образом:
NaHCO3 = Na+ + HCO3—
Mg(HSO4)2 = Mg2+ + 2HSO4—
Основные соли — это продукты неполного замещения гидроксогрупп в основании на кислотный остаток. Например, к таким солям относится знаменитый малахит (CuOH)2CO3, о котором вы читали в произведениях П. Бажова. Он состоит из двух основных катионов CuOH+ и двухзарядного аниона кислотного остатка CO32-. Катион CuOH+ имеет заряд +1, поэтому в молекуле два таких катиона и один двухзарядный анион CO32- объединены в электронейтральную соль.
Названия таких солей будут такими же, как и у нормальных солей, но с прибавлением приставки гидроксо-, (CuOH)2CO3 — гидроксокарбонат меди (II) или AlOHCl2 — гидроксохлорид алюминия. Большинство основных солей нерастворимы или малорастворимы.
Последние диссоциируют так:
AlOHCl2 = AlOH2+ + 2Cl—
Свойства солей
Типичные реакции солей:
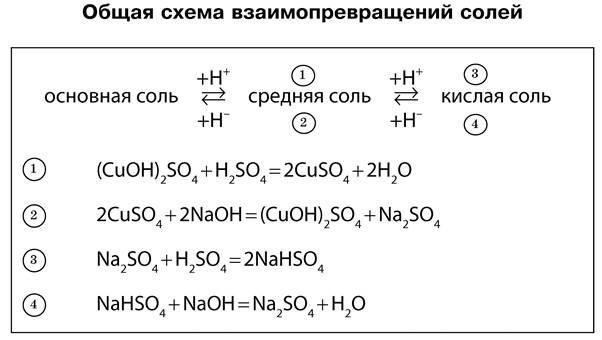
Первые две реакции обмена были подробно рассмотрены ранее.
Третья реакция также является реакцией обмена. Она протекает между растворами солей и сопровождается образованием осадка, например:
Четвертая реакция солей связана с положением металла в электрохимическом ряду напряжений металлов (см. «Электрохимический ряд напряжений металлов»). Каждый металл вытесняет из растворов солей все другие металлы, расположенные правее его в ряду напряжений. Это соблюдается при выполнении следующих условий:
1) обе соли (и реагирующая, и образующаяся в результате реакции) должны быть растворимыми;
2) металлы не должны взаимодействовать с водой, поэтому металлы главных подгрупп I и II групп (для последней начиная с Са) не вытесняют другие металлы из растворов солей.

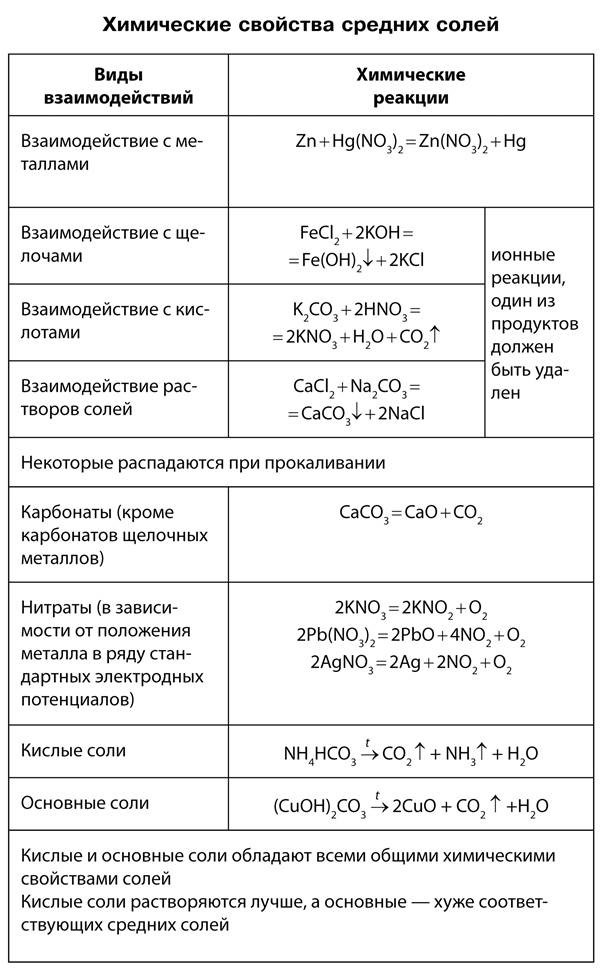
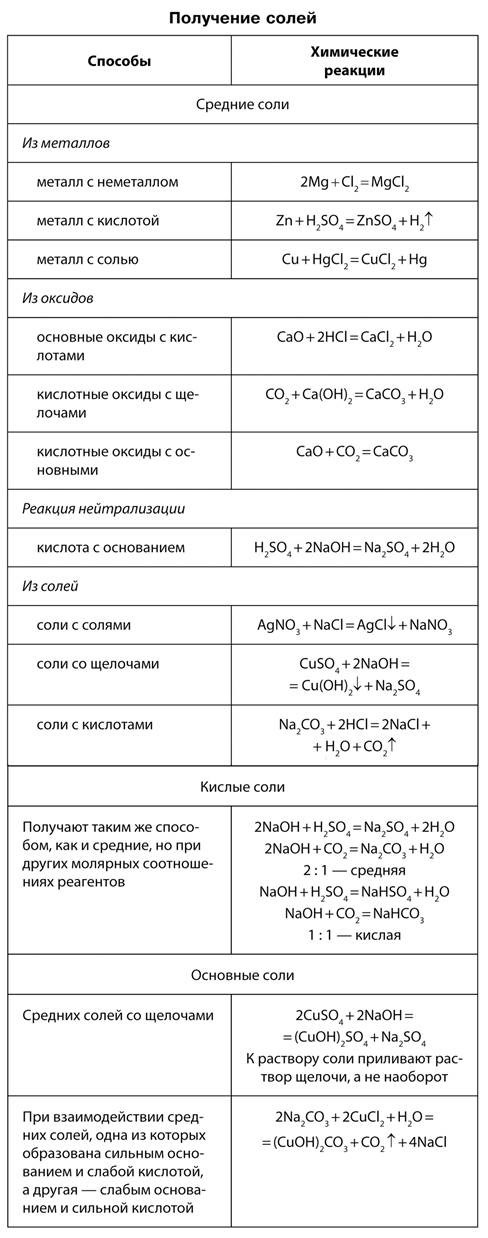
Способы получения солей
Способы получения и химические свойства солей. Соли могут быть получены из неорганических соединений практически любого класса. Наряду с этими способами соли бескислородных кислот могут быть получены при непосредственном взаимодействии металла и неметалла (Cl, S ит. д.).
Многие соли устойчивы при нагревании. Однако соли аммония, а также некоторые соли малоактивных металлов, слабых кислот и кислот, в которых элементы проявляют высшие или низшие степени окисления, при нагревании разлагаются.
СаСO3 = СаО + СO2
2Ag2CO3 = 4Ag + 2СO2 + O2
NH4Cl = NH3 + НСl
2KNO3 = 2KNO2 + O2
2FeSO4 = Fe2O3 + SO2 + SO3
4FeSO4 = 2Fe2O3 + 4SO2 + O2
2Cu(NO3)2 = 2CuO + 4NO2 + O2
2AgNO3 = 2Ag + 2NO2 + O2
NH4NO3 = N2O + 2H2O
(NH4)2Cr2O7 = Cr2O3 + N2 + 4H2O
2КСlO3 =MnO2= 2KCl + 3O2
4KClO3 = 3КСlO4 + KCl
Шпаргалки
Справочный материал для прохождения тестирования:



























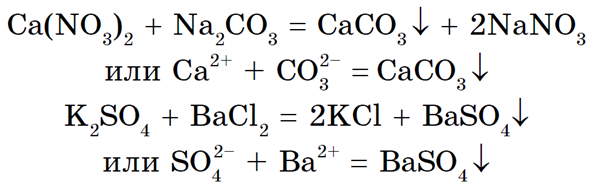









Соли — интересная тема во всех смыслах. Отличная статья для обобщения и закрепления знаний. Распечатала даже статью, чтобы почитать перед экзаменом.
Очень информативная статья. В свое время прогуливала химию, теперь пригодилась эта информация!
Хорошая статья и сайт в целом. Прекрасное дополнение к тому, что изучают в школе. А если в ней почти ничего не изучают, то такой сайт просто спасение.
Я учился очень давно и по химии ничего не помню. Подскажите, пожалуйста, я могу своему ребенку эту статью предложить в виде учебного материала для выпускника школы или это не по школьной программе?
Все уроки формируются по темам школьной программы, в соответствии со стандартами образования. Вся программа расчитана на подготовку к ЕГЭ по химии! Удачи в обучении!
Кратко и доступно изложена информация про соли. Жаль, что во время моего обучения в школе информация так не излагалась.Может быть знала химию лучше.
Скорее всего, нам просто эту информацию преподносили не в самом качественном и интересном виде. Заинтересованность ученика в материале это уже больше половины успеха.
Довольно-таки познавательная статься, а самое главное — в ней все коротко и по сути. Мой сын готовится к ЕГЭ, думаю показать ему эту статью, информация наверняка пригодится.
Моя любимая тема еще со школьной скамьи, спасибо автору что помог вспомнить забытое, статья написана доступным языком.